
परमाणु की संरचना:
Class 9 Science Chapter 4. परमाणु की संरचना
| पाठ्यपुस्तक | NCERT |
| कक्षा | कक्षा 9 |
| विषय | विज्ञान |
| अध्याय | अध्याय 4 |
| प्रकरण | परमाणु की संरचना |
परमाणु की संरचना
जॉन डाल्टन ने परमाणु को अविभाज्य इकाई माना था पर उनका यह तथ्य 19वीं शताब्दी के अंत में नकार दिया गया, असल में वैज्ञानिकों ने उस दौरान परमाणु में आवेशित कणों जैसे कि इलेक्ट्रॉन, प्रोटॉन और अनावेशित कण न्यूट्रॉन की खोज की। इन कणों को उप- परमाण्विक कण कहा जाता है।
इलेक्ट्रॉन की खोज – जे. जे. टॉमसन (1897)
टॉमसन ने कैथोड किरणों की मदद से परमाणु में इलेक्ट्रॉन की उपस्थिति के बारे में बताया।
इलेक्ट्रॉन के बारे में कुछ महत्वपूर्ण तथ्य –
इलेक्ट्रॉन पर आवेश = -1.602 x 10-19 C (C = कूलाम)
इलेक्ट्रॉन पर द्रव्यमान = 9.109 x 10-31 Kg
प्रोटॉन की खोज – ई. गोल्डस्टीन (1886)
ई. गोल्डस्टीन ने उनके द्वारा प्रसिद्ध एनोड किरणों या केनाल किरणों के प्रयोग द्वारा परमाणु में धनावेशित कण यानि प्रोटॉन की खोज की।
प्रोटॉन के बारे में कुछ महत्वपूर्ण तथ्य –
प्रोटॉन पर आवेश = + 1.602 x 10-19 C
प्रोटॉन का द्रव्यमान = 1.672 x 10-27 Kg
यानि प्रोटॉन का द्रव्यमान = 1840 x इलेक्ट्रॉन का द्रव्यमान
न्यूट्रॉन की खोज – जेम्स चैडविक (1932)
जेम्स चैडविक ने हल्के तत्व (जैसे लिथियम, बोरोन इत्यादि) की α- कणों के साथ भिड़ंत करवाई जिसके कारणवश एक नए कण जिनका द्रव्यमान प्रोटॉन के बराबर था, तथा वे आवेश रहित थे, की उत्पत्ति सिद्ध की। इन कणों को न्यूट्रॉन का नाम दिया गया।
न्यूट्रॉन, हाइड्रोजन के प्रोटियम समस्थानिक में नहीं होते हैं।
क्योंकि इलेक्ट्रॉन का द्रव्यमान प्रोटॉन तथा न्यूट्रॉन के द्रव्यमान से अत्यधिक कम है, इसलिए परमाणु का द्रव्यमान, प्रोटॉन और न्यूट्रॉन के द्रव्यमान का योग होगा।
परमाणु मॉडल:
उप-परमाण्विक कणों जैसे की इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन की खोज के उपरांत परमाणु के विभिन्न मॉडल दिए गए। उनमें से कुछ परमाणु के मॉडल इस तरह से है।
1. टॉमसन का परमाणु मॉडल
2. रदरफोर्ड का परमाणु मॉडल
3. बोर का परमाणु मॉडल
इन दिनों ‘क्वांटम यांत्रिकी परमाणु मॉडल’ वैज्ञानिक तौर पर सही पाया गया है और इसी मॉडल को स्वीकृति दी गई है। इस मॉडल को उच्च कक्षाओं में पढ़ाया जाएगा।
1. टॉमसन का परमाणु मॉडल:
➲ टॉमसन के इस परमाणु मॉडल को ‘कटा तरबूज मॉडल’ कहते हैं।
➲ टॉमसन के इस परमाणु मॉडल में धन आवेश, तरबूज के खाने वाले लाल भाग की तरह बिखरा है, जबकि इलेक्ट्रॉन, धनावेशित गोले में तरबूज के बीज की भांति धँसे है।

हालांकि इस मॉडल ने परमाणु के आवेशरहित अभिलक्षण की विवेचना की पर कुछ वैज्ञानिक को यह मॉडल नहीं समझ आया इसलिए इसे नकार दिया गया।
2. रदरफोर्ड का परमाणु मॉडल:
रदरफोर्ड ने अपने एक प्रसिद्ध प्रयोग (अल्फा कण प्रकीर्णन) द्वारा तेजी से चल रहे अल्फा (हिलियम नाभिक 2He4 ) कणों को सोने के पन्नी से टक्कर कराई और उसके परिणाम को अवलोकन कर परमाणु के नाभिकीय मॉडल प्रस्तुत किया जो इस प्रकार है।

रदरफोर्ड के प्रयोग के परिणाम –
➲ ज्यादातर अल्फा कण बिना मुड़े सोने की पन्नी से सीधे निकल गए।
➲ कुछ अल्फा कण निम्न कोणों से मुड़े।
➲ प्रत्येक 12000 कणों में से 1 कण वापस आ गया।
रदरफोर्ड के प्रयोग के परिणाम का निष्कर्ष –
अपने प्रयोग के परिणामों के आधार पर रदरफोर्ड ने निम्नलिखित निष्कर्ष निकाले –
➲ परमाणु के भीतर का अधिकतर भाग खाली है क्योंकि अधिकतर अल्फा कण बिना मुड़े सोने की पन्नी से बाहर निकल जाते हैं।
➲ परमाणु के बीच एक धन आवेशित गोला है जिसे नाभिक कहा जाता है क्योंकि 12000 में से 1 अल्फा कण वापस आ गया।
➲ क्योंकि ज्यादातर अल्फा कण सोने की पन्नी से सीधे निकल गए और कुछ ही कणों में झुकाव देखा गया, इस आधार पर उन्होंने यह निष्कर्ष निकला कि परमाणु के भीतर ज्यादातर भाग खाली हैं और नाभिक इस खाली भाग के बहुत छोटे से भाग में मौजूद होता है।
➲ नाभिक का आयतन = 10-5 x परमाणु के आयतन
➲ परमाणु का संपूर्ण द्रव्यमान उसके नाभिक में होता है।
रदरफोर्ड ने परमाणु मॉडल की विशेषताएं –
अपने प्रयोग के आधार पर रदरफोर्ड ने परमाणु का मॉडल प्रस्तुत किया जिसमें निम्नलिखित विशेषताएं थी।
➲ परमाणु का केंद्र धनावेशित होता है जिसे नाभिक कहा जाता है। एक परमाणु का संपूर्ण द्रव्यमान नाभिक में होता है।
➲ इलेक्ट्रॉन नाभिक के चारो और वलयकार मार्ग में चक्कर लगाते हैं।
➲ नाभिक का आकार परमाणु के आकार की तुलना में काफी कम होता है।
रदरफोर्ड के परमाणु मॉडल की कमियां –
➲ रदरफोर्ड के अनुसार इलेक्ट्रॉन नाभिक के चारो ओर वलयाकार मार्ग में चक्कर लगाते हैं, किंतु आवेशित होने के कारण यह कण अपनी ऊर्जा निरंतर खोते रहते हैं, जिसके कारण वह अंततः नाभिक में प्रवेश कर परमाणु को अस्थिर बनाते हैं।
➲ यह रदरफोर्ड परमाणु मॉडल की सबसे बड़ी कमी थी, जिसे रदरफोर्ड समझा नहीं पाया।
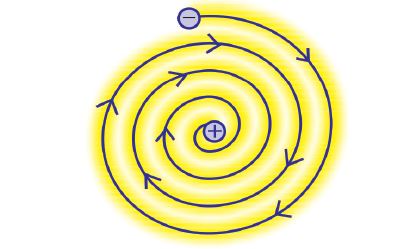
3. बोर का परमाणु मॉडल:
रदरफोर्ड मॉडल की कमी का निवारण बोर के परमाणु मॉडल से हुआ। नील्स बोर ने 1912 में परमाणु को बारे में अपना मॉडल प्रस्तुत किया जिसमें निम्नलिखित तथ्य मौजूद थे –
➲ इलेक्ट्रॉन केवल कुछ निश्चित कक्षाओं में ही चक्कर लगा सकते हैं, जिन्हें इलेक्ट्रॉन की निर्धारित कक्षा कहते हैं।
➲ इन निर्धारित कक्षाओं में चक्कर लगाते हुए ये इलेक्ट्रॉन अपनी उर्जा का विकिरण नहीं करते।
➲ किसी भी परमाणु के इलेक्ट्रॉन की ऊर्जा में बदलाव, इन इलेक्ट्रॉन की कक्षाओं में स्थानांतरण के कारण होता है।

परमाणु संख्या (Atomic number):
किसी भी परमाणु में प्रोटॉन की कुल संख्या का मान उसकी परमाणु संख्या कहलाती है।
परमाणु संख्या किसी भी परमाणु का परिचायक होता है, इसमें बदलाव किसी भी परमाणु के स्वरूप में बदल देता है।
परमाणु संख्या ‘Z’ द्वारा प्रदर्शित की जाती है।

किसी भी अनावेशित परमाणु में प्रोटॉन तथा इलेक्ट्रॉन की संख्या बराबर होती है।
द्रव्यमान संख्या (Mass number):
▪ द्रव्यमान संख्या किसी परमाणु के नाभिक में मौजूद प्रोटॉन तथा न्यूट्रॉन की संख्या का जोड़ होता है।
▪ द्रव्यमान संख्या को ‘A’ द्वारा प्रदर्शित किया जाता है।

परमाणु का प्रस्तुतीकरण
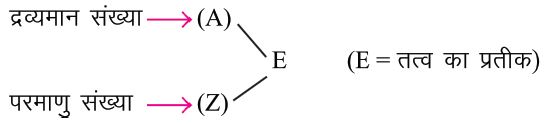
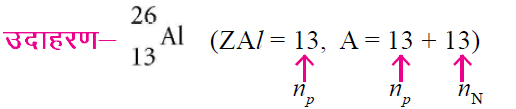
प्रश्न – निम्नलिखित परमाणु में प्रोटॉन इलेक्ट्रॉन और न्यूट्रॉन की संख्या बताएं –

“विभिन्न कक्षाओं में इलेक्ट्रॉन का वितरण”
विभिन्न कक्षाओं में इलेक्ट्रॉन का वितरण “बोर-बरी” नियम के अनुसार किया जाता है।
“बोर बरी नियम”
इस नियम को निम्नलिखित तरीके से बताया जा सकता है –
इलेक्ट्रॉन का परमाणु में वितरण “2n2 ” पद्धति द्वारा किया जाता है, जहां n = कक्षा की संख्या और “2n2 ” = इलेक्ट्रॉन की पूर्ण संख्या जो किसी भी कक्षा में समाहित हो सकती है।
अगर, n = 1 या K कक्षा, 2n2 = 2 x 12 = 2 e’s
n = 2 या L कक्षा, 2n2 = 2 x 22 = 8 e’s
n = 3 या M कक्षा, 2n2 = 2 x 32 = 18 e’s
n = 4 या N कक्षा, 2n2 = 2 x 42 = 32 e’s
किसी परमाणु की आखिरी कक्षा में 8 इलेक्ट्रॉन से ज्यादा इलेक्ट्रॉन नहीं हो सकते जबकि आखिरी से दूसरी कक्षा में 18 से ज्यादा इलेक्ट्रॉन नहीं हो सकते, उस स्थिति में भी जब इसी कक्षा में 18 से ज्यादा इलेक्ट्रॉन रखने की क्षमता हो।
उदाहरण –
K L M N
Ca20 = 2, 8, 8, 2
2, 8, 10, x ‘M’ कक्षा मे 18 इलेक्ट्रॉन लाए जा सकता है।
आखिरी कोश में 2 इलेक्ट्रॉन से ज्यादा तब तक नहीं आ पाएंगे जब आखिरी से दूसरी कक्षा में 8 इलेक्ट्रॉन भरे जा चुके हो और आखरी से तीसरी कक्षा में 2n2 नियमानुसार पूर्ण रूप से भरी जा चुकी हो।
उदाहरण –

2 x 22 = 8 “2n2” नियमानुसार पूर्ण रूप से भरी जा चुकी है।
कुछ अन्य उदाहरण –
- K19 – 2, 8, 8,1
- Al13 – 2, 8, 3
- F9 – 2, 7
- Ne10 – 2, 8
- Na11 – 2, 8, 1
संयोजकता (Valency):
बोरबरी नियम के अनुसार हमें ज्ञात है कि किसी भी परमाणु के अंतिम कोश में 8 इलेक्ट्रॉन भरे जा सकते हैं।
हर तत्व अपनी बाहरी कोष में 8 इलेक्ट्रॉन भरने के लिए इलेक्ट्रॉन को अपने में से मुक्त या अन्य तत्वों में से इलेक्ट्रॉन को ग्रहण करते हैं।
8 इलेक्ट्रॉन अपने अंतिम कोष में रखने हेतु जो भी इलेक्ट्रॉन कोई तत्व लेता या देता है इलेक्ट्रॉन की इस संख्या जो लेने देने में उपयोग होती है उसे संयोजकता कहते हैं।
उदाहरण –
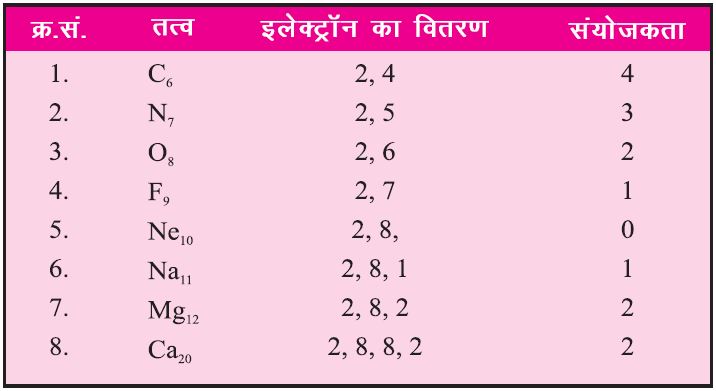
हल्के तत्व जैसे हाइड्रोजन (H), हिलियम (He), लिथियम (Li), बेरिलियम (Be) और बोरोन (B) अपने अंतिम कोष में 2 इलेक्ट्रॉन भरते हैं।
अपने अंतिम कोष में 2 इलेक्ट्रॉन भरने हेतु जितने भी इलेक्ट्रॉन या ग्रहण करें, वह उनकी संयोजकता कहलाती है।
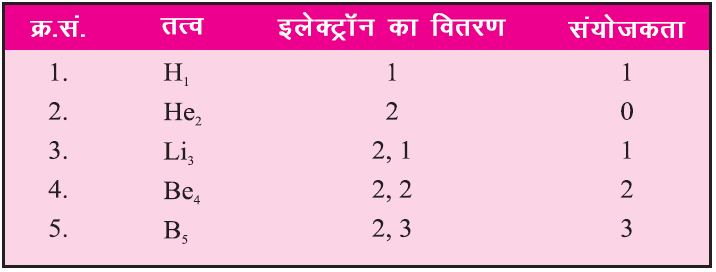
समस्थानिक – एक ही तत्व के ऐसे परमाणु जिनके परमाणु संख्या बराबर हो पर द्रव्यमान संख्या भिन्न हो, ऐसे परमाणु समस्थानिक कहलाये जाते हैं।
उदाहरण –
क्लोरीन के दो समस्थानिक होते हैं जिनकी द्रव्यमान संख्या ‘35’ और ‘37’ होती है।
17Cl35 तथा 17Cl37
उपयोग –
▪ यूरेनियम समस्थानिक का उपयोग परमाणु संयंत्र में ईंधन के तौर पर क्या जाता है।
▪ कोबाल्ट का समस्थानिक कैंसर के उपचार में उपयोग किया जाता है।
▪ आयोडीन के समस्थानिक का प्रयोग घेंघा के उपचार में किया जाता है।
अपेक्षित द्रव्यमान संख्या:
तत्वों के समस्थानिकों का औसत द्रव्यमान
क्लोरीन में 75% Cl35 तथा 25% Cl37 उपस्थित होता है ।
अपेक्षित द्रव्यमान संख्या = 75% of Cl35 + 25% of Cl37
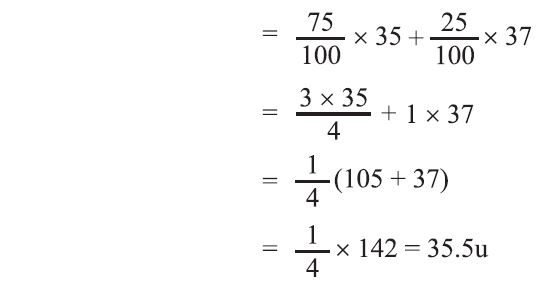
समभारिक – अलग-अलग तत्वों के ऐसे परमाणु जिनकी द्रव्यमान संख्या एक जैसी हो परंतु परमाणु संख्या भिन्न हो, समभारिक कहलाये जाते हैं।
उदाहरण –
20 Ca 40 तथा 18 Ar 40
11 Ca 24 तथा 12 Ar 24
