
हमारे आस-पास के पदार्थ
Class 9 Science Chapter 1. हमारे आस-पास के पदार्थ
| पाठ्यपुस्तक | NCERT |
| कक्षा | कक्षा 9 |
| विषय | विज्ञान |
| अध्याय | अध्याय 1 |
| प्रकरण | हमारे आस-पास के पदार्थ |
पदार्थ (Matter):
संसार का कोई भी चीज जो स्थान घेरे, जिसमें द्रव्यमान हो और जो अवरोध उत्पन्न करे, पदार्थ कहलाती है । हमारे चारों ओर मौजूद सभी चीजें पदार्थ से बनी हैं । जैसे पेन, पेंसिल, किताब, टेबल, दीवार, आदि ।
पदार्थ के भौतिक प्रकृति (Physical Nature of Matter):
1. पदार्थ कणों से मिलकर बना होता है।
2. पदार्थ के कण अत्यंत छोटे होते हैं।
3. पदार्थ के कण निरंतर गति करते हैं।
यानी उनके पास गतिज ऊर्जा होती है। तापमान बढ़ने से कणों की गति तेज हो जाती है क्योंकि कणों की गतिज ऊर्जा बढ़ जाती है।
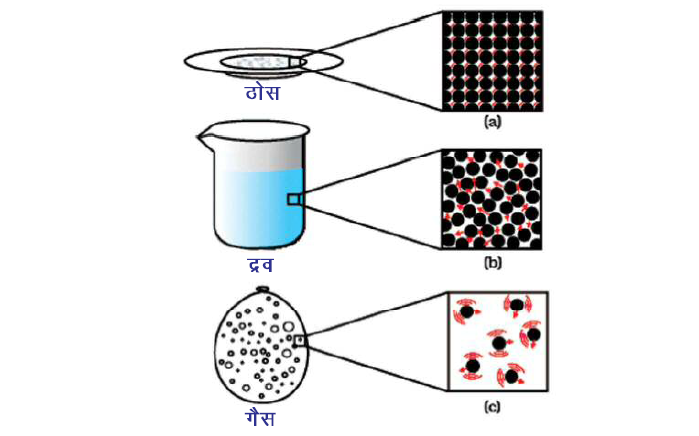
गैसीय अवस्था में कणों में गति अधिकतम होती है द्रव अवस्था में मध्यम होती है और ठोस अवस्था में न्यूनतम होती है।
4. पदार्थ के कण एक-दूसरे को आकर्षित करते हैं।
जब हम पानी के नल को खोलते हैं और पानी की धारा को अपनी अंगुली से तोड़ने की कोशिश करते हैं क्या वह धार टूट जाती है – नहीं। क्योंकि पानी की धारा जुड़ी रहती है। इसका मतलब यह है पानी के कण एक-दूसरे के साथ आकर्षण बल से जुड़े होते हैं।
आकर्षण बल भी ठोस में अत्यधिक, द्रव में मध्यम और गैस में सबसे कम होता है।
5. पदार्थ के कणों के बीच रिक्त स्थान होता हैं।
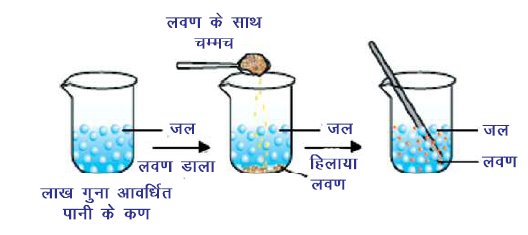
जब हमें चाय, कॉफी या नींबू पानी बनाते हैं तो एक तरह के पदार्थ के कण दूसरे तरह के पदार्थ के कणों के बीच उपस्थित रिक्त स्थान में समावेशित हो जाते हैं। इससे पता चलता है कि पदार्थ के कणों के बीच में पर्याप्त रिक्त स्थान होता है।
पदार्थ के कणों के बीच का रिक्त स्थान और उनकी गतिज ऊर्जा ठोस पदार्थों में सबसे कम होती है, द्रव अवस्था में मध्यम और गैसीय अवस्था में अत्यधिक होते हैं।
पदार्थ की अवस्थाएं (States of Matter):

भौतिक गुणों के आधार पर पदार्थ तीन अवस्थाओं में पाया जाता है । पदार्थ की ये अवस्थाएं उनकी कणों की विभिन्न विशेषताओं के कारण होता है ।
1. ठोस अवस्था (The Solid State)
2. द्रव अवस्था (The Liquid State)
3. गैसीय अवस्था (The Gaseous State)
हम मानव शरीर को भी पदार्थ की तीन अवस्थाओं में विभाजित कर सकते हैं।
हड्डियों और दांत – ठोस अवस्था
रक्त (Blood) और जल – द्रव अवस्था
फेफड़ों में हवा – गैसीय अवस्था
एक अनुमान के अनुसार हमारे शरीर के कुल भार का लगभग 70% पानी पाया जाता है।
1. ठोस अवस्था (The Solid State):
1. ठोस पदार्थों का एक निश्चित आकार (shape) और एक निश्चित आयतन (volume) होता है।
2. इसका घनत्व (density) उच्च (high) होता है ।
3. इसका द्रवनांक (melting point) और क्वथनांक (boiling point) उच्च होता है ।
4. ठोस पदार्थ कठोर (hard) और दृढ़ (rigid) होता है ।
5. इनकी संपीड्यता नगण्य (incompressible) होती है।
6. ठोस पदार्थों में बहाव (flow) नही होती है ।
7. गर्म या ठंडा करने पर ठोस पदार्थों का क्रमशः प्रसार (expansion) या संकुचन (contraction) बहुत ही कम होता है ।
✍ बल लगाने से रबड़ बैंड का आकार बदल जाता है, लेकिन बल हटा लेने से यह पुनः अपने मूल आकार में आ जाता है। अगर अत्यधिक बल लगाया जाए तो रबड़ बैंड टूट जाता है।
✍ ठोस पदार्थों में कणों की गतिज ऊर्जा न्यूनतम होती है इसलिए ठोस पदार्थ का एक निश्चित और दृढ़ (rigid) आकार होता है।
✍चीनी और नमक जिस बर्तन में रखे जाते हैं उसी बर्तन का आकार ले लेते हैं। लेकिन ये ठोस पदार्थ है। क्योंकि क्रिस्टलो का आकार वही रहता है।
✍ हाथ से दबा कर स्पंज को काफी हद तक संपीडित कर सकते हैं। लेकिन फिर भी यह ठोस है। कारण यह है कि स्पंज के छिद्रों में हवा भरी होती है, दबाने से हवा बाहर निकल जाती है।
2. द्रव अवस्था (The Liquid State)
1. द्रव का कोई निश्चित आकार नहीं होता किन्तु उसका आयतन निश्चित होता है।
2. द्रव का घनत्व उसके ठोस रूप के धनत्व से कम होता है ।
3. इसका द्रवनांक (melting point) और क्वथनांक (boiling point) ठोस पदार्थों से प्रायः कम होता है ।
4. द्रव में बहुत कम संपीडन (ठोस की तुलना में थोड़ा अधिक) होता है।
5. द्रव पदार्थों में बहाव (flow) की प्रवृति पाई जाती है ।
✍ द्रव के कणों का आकर्षण बल, उसका आयतन निश्चित रखता है ।
✍ द्रव जिस बर्तन में रखे जाते हैं वह उसी बर्तन का आकार ले लेते हैं। द्रव के कणों का आकर्षण बल, उसका आयतन निश्चित रखता है।
✍गैसें जैसे ऑक्सीजन और कार्बन डाइऑक्साइड पानी में विसरण करती है और यही जलीय पौधे व जीव (aquatic plants and animals) पानी में घुली ऑक्सीजन के कारण ही पानी में सांस ले पाते हैं।
✍ द्रव अवस्था में विसरण (diffusion) अधिक होता है और ठोस अवस्था में कम होता है क्योंकि कणों में गति द्रव में ज्यादा होती है, और ठोस में कणों की गति कम होती है।
3. गैसीय अवस्था (The Gaseous State)
1. गैस में न तो कोई निश्चित आकृति होती है और न कोई निश्चित आयतन ।
2. ठोस एवं द्रवों की तुलना में गैसों का घनत्व निम्न होता है ।
3. इसका द्रवनांक (melting point) और क्वथनांक (boiling point) कमरे के ताप से कम होता है ।
4. गैसों की संपीड्यता (compressibility) बहुत अधिक होती है।
5. गैसों में बहाव (flow) होता है।
6. गर्म या ठंडा करने पर गैस को क्रमशः प्रसारित (expand) या संकुचित (compress) किया जा सकता है ।
✍ गैस में कण इधर-उधर घूमने के लिए पूरी तरह से स्वतंत्र होते हैं, उनमें आकर्षण बल कम होता है इसलिए गैसों में बहाव होता है।
✍ गैस का कोई निश्चित आयतन नहीं होता है, इसलिए गैस जिस भी बर्तन में रखी जाती है, वह उसी बर्तन का आयतन घेर लेती है।
✍ गैसीय अवस्था में कण अनियमित रूप से तेजी से गति करते हैं। इसी कारण कण आपस में और बर्तन की दीवारों से टकराते हैं। बर्तन की दीवार पर गैस कणों द्वारा प्रति इकाई क्षेत्र पर लगे बल के कारण गैस का दबाव बनता है।
पदार्थ की अवस्था में परिवर्तन (Change of states of Matter)
पानी पदार्थ की तीनों अवस्थाओं में मिलता है।
ठोस – बर्फ
द्रव – पानी
गैसीय – वाष्प
✍ गर्म करने पर बर्फ पानी में परिवर्तित हो जाती है और पानी वाष्प में परिवर्तित हो जाता है। पदार्थ की भौतिक अवस्था को दो तरीकों से परिवर्तित किया जा सकता है।
तापमान में परिवर्तन
a. गलनांक (Melting point) –
जिस तापमान पर (वायुमंडलीय दाब पर) कोई ठोस पिघल पर द्रव बनता है, वह इसका गलनांक कहलाता है। बर्फ का गलनांक 273.16 K है। सुविधा के लिए हम इसे 0o C अर्थात 273 K लेते हैं।
जब बर्फ पिघलती है, बर्फ का तापमान नहीं बढ़ता है, लगातार ऊष्मा प्रदान करने के बावजूद, क्योंकि संगलन की गुप्त ऊष्मा, तापमान को बढ़ने नहीं देती है।
संगलन की गुप्त ऊष्मा – वायुमंडलीय दाब पर 1 Kg ठोस को उसके गलनांक पर द्रव में बदलने के लिए जितनी ऊष्मा ऊर्जा की आवश्यकता होती है, उसे संगलन की गुप्त ऊष्मा कहते हैं। अतः 0o C बर्फ के कणों की तुलना में 0o C पर पानी के कणों से अधिक ऊर्जा होती है।
क्वथनांक (Boiling Point) – वायुमंडलीय दाब पर वह तापमान जिस पर द्रव उबलने लगता है, इसका क्वथनांक कहलाता है। क्वथनांक समष्टि गुण है।
जल का क्वथनांक = 373 K (100o C + 273 = 373 K)
वाष्पीकरण की गुप्त ऊष्मा – वायुमंडलीय दाब पर 1Kg द्रव को उसके क्वथनांक पर वाष्प में बदलने के लिए जितनी उष्मीय ऊर्जा की आवश्यकता होती है, उसे वाष्पीकरण की गुप्त ऊष्मा कहते हैं
जब पानी को उबाला जाता है, तो उसके तापमान में वृद्धि नहीं होती है तापमान 100o C ही रहता है क्योंकि वाष्पीकरण की गुप्त ऊष्मा, पानी के कणों के बीच के आकर्षण बल को तोड़ती है।
अतः 100o C तापमान पर वाष्प के कणों में उसी तापमान पर पानी के कणों की अपेक्षा अधिक ऊर्जा होती है।
तापमान में परिवर्तन से पदार्थ की अवस्था को एक से दूसरे में बदला जा सकता है जैसा कि नीचे के आरेख में दिखाया गया है ।

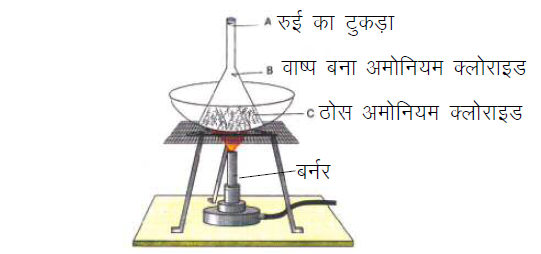
ऊर्ध्वपातन (Sublimation):
कुछ ऐसे पदार्थ है जिसे गर्म किए जाने पर बिना द्रव अवस्था में परिवर्तित हुए सीधे गैस की अवस्था में बदल जाते हैं और उस गैस को ठंडा करने पर बिना द्रव में बदले वापस ठोस में बदल जाते हैं। इस प्रक्रिया को ऊर्ध्वपातन कहते हैं।
उदाहरण – थोड़ा सा कपूर या अमोनियम क्लोराइड (नैसादर) लेकर इसका चूर्ण करके चीनी की प्याली में डालिए । चीनी की प्याली पर कीप को उल्टा करके रखिए । कीप के सिरे पर रुई की डाट लगा दीजिए । धीरे-धीरे गरम कीजिए । हम देखेंगे कि कपूर या अमोनियम क्लोराइड ठोस से गैसीय अवस्था में बदल जाता है । कीप की भीतरी दीवारों पर पदार्थ के वाष्प संघनित होते हैं।
b. दाब परिवर्तन पर प्रभाव
यदि हम तापमान घटाने पर सिलेंडर में गैस लेकर उसे संपीडित करें, तो कणों के बीच की दूरी कम हो जाएगी और गैस द्रव में बदल जाएगी।
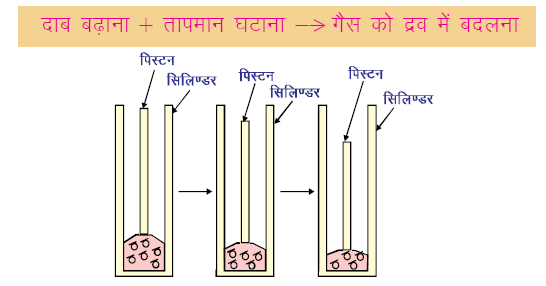
ज्यादा दाब बढ़ाने से गैस के कण नजदीक आ जाते हैं।
ठोस कार्बन डाइऑक्साइड (Solid Carbon dioxide) को वापिस गैसीय कार्बन डाइऑक्साइड (CO2) में बदला जा सकता है बिना द्रव अवस्था में बदले । इसके लिए दाब को घटाकर 1 एटमॉस्फेयर तक करना होता है।
शुष्क बर्फ (dry ice) – ठोस कार्बन डाइऑक्साइड (Solid CO2)
दाब और तापमान के प्रभाव से पदार्थों की तीनों अवस्थाओं का अंतरा रूपांतरण इस प्रकार है
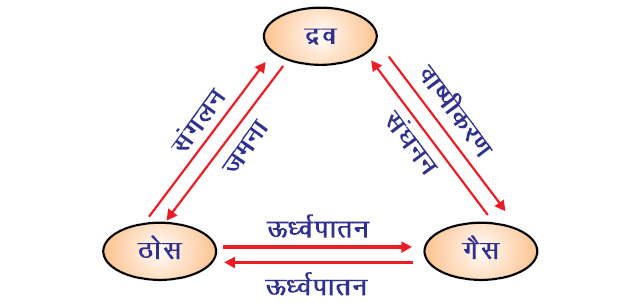
वाष्पीकरण (Evaporation):
एक ऐसी सतही प्रक्रिया जिसमें द्रव पदार्थों में सतह के कण क्वथनांक से नीचे किसी भी तापमान पर वाष्प में बदलने लगते हैं। ऐसी प्रक्रिया को वाष्पीकरण कहते हैं।
सतह पर उपस्थित कणों में उच्च गतिज ऊर्जा के कारण वे अन्य कणों के आकर्षण बल से मुक्त हो जाते हैं और इसी कारण से वाष्प में बदल जाते हैं।
वाष्पीकरण को प्रभावित करने वाले कारक
द्रव की प्रकृति – द्रव का क्वथनांक जितना ही कम रहता है उसका वाष्पीकरण उतना ही तेजी से होता है ।
सतही क्षेत्रफल – सतही क्षेत्रफल बढ़ाने से वाष्पीकरण की दर बढ़ जाती है।
तापमान में वृद्धि – तापमान बढ़ाने से वाष्पीकरण की दर बढ़ जाती है क्योंकि पदार्थ के कणों की गतिज ऊर्जा बढ़ जाती है।
वायु की गति – अगर वायु की गति बढ़ जाती है तो वाष्पीकरण की दर भी बढ़ जाती है।
आद्रता (Humidity) – अगर हवा में आद्रता है तो वाष्पीकरण की दर घट जाती है। ज्यादा आद्रता कम वाष्पीकरण
वाष्पीकरण से शीतलता होती है ।
वाष्पीकरण प्रक्रिया के दौरान लुप्त हुई ऊर्जा को पुनः प्राप्त करने के लिए द्रव के कण अपने आस-पास के वातावरण से उर्जा, अवशोषित कर लेते हैं। इस अवशोषण के कारण वातावरण शीतल हो जाता है।
उदाहरण –अगर हम हाथ पर एसीटोन (Acetone) डालते हैं तो एसीटोन हमारे हाथ से ऊष्मा लेकर वाष्प में परिवर्तित हो जाता है और इसी कारण हमें हाथ पर शीतलता महसूस होती है।
गर्मी में हमें सूती कपड़े पहनने चाहिए क्योंकि गर्मियों में पसीना अधिक आता है। सूती कपड़े पानी के अच्छे अवशोषक होने के कारण पसीना अवशोषित करके वायुमंडल में आसानी से वाष्पीकरण कर देते हैं। चूंकि वाष्पीकरण से शीतलता होती है अतः गर्मी में सूती कपड़ों से आराम मिलता है।
गर्मियों में अक्सर लोग मैदानों में पानी छिड़कते हैं। यह पानी मैदानों से उर्जा (गर्मी) प्राप्त करके वाष्प में बदल जाता है और उस जगह को ठंडा कर देता है।
