तत्वों का आवर्त वर्गीकरण-
Class 10 Science Chapter 5 तत्वों का आवर्त वर्गीकरण
| पाठ्यपुस्तक | NCERT |
| कक्षा | कक्षा-10 |
| विषय | विज्ञान |
| अध्याय | अध्याय 5 |
| प्रकरण | तत्वों का आवर्त वर्गीकरण |
परिचय (Introduction):
- हमारे आस पास के पदार्थ तत्व, मिश्रण एवं यौगिक के रूप में उपस्थित रहते हैं।
- ऐसे पदार्थ जो एक ही प्रकार के अणुओं (atoms) से मिलकर बने है, तत्व कहलाते हैं। उदाहरण– सोडियम, सोना, मैग्नीशियम।
- अभी तक 118 तत्व ज्ञात है।
वर्गीकरण की आवश्यकता क्यों?
तत्व को सुव्यवस्थित ढंग से पढ़ने के लिए तथा उनके अध्ययन को आसान बनाने हेतु उनको वर्गीकृत किया गया।
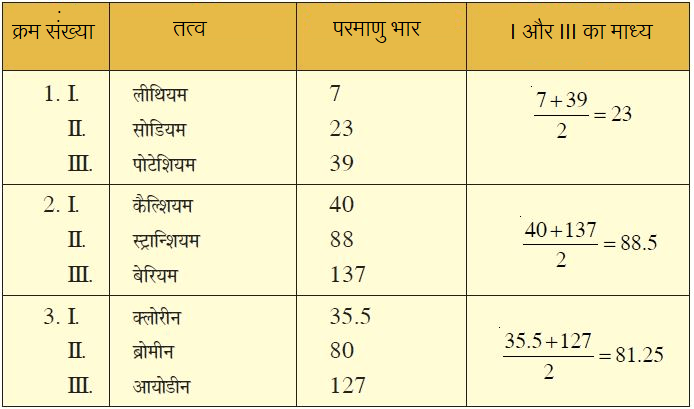
डॉबेराइनर का त्रियक (Dobereiner’s Traids):
जब तत्व को उनके बढ़ते हुए परमाणु भार के अनुसार क्रमवार लगाया जाए तो तीन तत्वों के समूह प्राप्त होते हैं जिन्हें त्रियक (Traids) कहा गया। त्रियक के मध्य तत्व का परमाणु भार अन्य दोनों तत्वों के परमाणु भार का माध्य अथवा औसत होता है।
उदाहरण-
सीमाएँ (Limitations):
उस समय तक ज्ञात तत्व में केवल 3 त्रिक ही ज्ञात कर सके थे।

न्यूलैंड्स का अष्टक सिद्धांत (Newland’s Law of Octaves):
न्यूलैंड्स का अष्टक नियम के अनुसार- यदि तत्वों को उनके बढ़ते हुए परमाणु भार के क्रम में व्यवस्थित किया जाए तो किसी भी तत्व से प्रारंभ करने पर आँठवे तत्व के गुण पहले तत्व के गुणों के समान होते हैं, जैसा की संगीत का आठवाँ स्वर पहले स्वर के समान होता है।

इसकी तुलना संगीत के अष्टक से की गई इसलिए इसे अष्टक का सिद्धांत (Law of Octaves) कहा गया। उदाहरण के लिए चूंकि सोडियम, लिथियम के बाद आठवाँ तत्व है, इसलिए लिथियम एवं सोडियम धातु के गुण समान हैं।
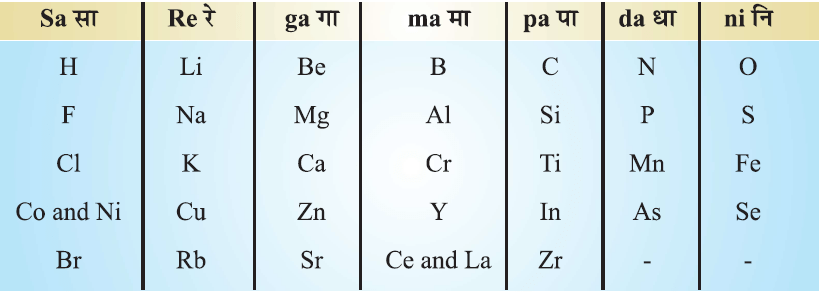
अष्टक सिद्धांत की सीमाएँ (Limitations):
- न्यूलैंड्स का अष्टक नियम केवल हल्के तत्वों (कैल्शियम तक) के लिए लागू होता है, भारी तत्वों के लिए नहीं।
- न्यूलैंड्स का अनुमान था कि प्रकृति में सिर्फ 56 तत्व ही है और आगे चलकर अन्य तत्वों का आविष्कार नहीं होंगे। किन्तु नए तत्वों के आविष्कार तथा उसके गुणधर्म इस सारणी से मेल नहीं खाते थे।
- सारणी में तत्वों को समंजित करने के लिए न केवल दो तत्वों को एक साथ रख दिया बल्कि असमान तत्वों जिनके गुणों में कोई समानता नहीं थी, एक स्थान में रख दिया।
- नोबल गैस की खोज हो जाने पर अष्टक सिद्धांत अप्रासंगिक हो गया क्योंकि अब नवम तत्व प्रथम तत्व के समान गुण वाला होता है न कि आठवाँ।
मेंडलीफ की आवर्त सारणी (Mendeleev’s Periodic Table):
- तत्वों के भौतिक तथा रासायनिक गुणधर्म उनके परमाणु द्रव्यमानों के आवर्त फलन है।
- मेंडलीफ की आवर्त सारणी तत्वों के रासायनिक गुणधर्मों पर आधारित है।
- मेंडलीफ की आवर्त सारणी में 8 ऊर्ध्वाधर स्तंभ (vertical columns) है जिन्हें समूह (Groups) कहते हैं तथा 6 क्षैतिज पंक्तियां (horizontal rows) हैं जिन्हें आवर्त (Periods) कहते हैं।
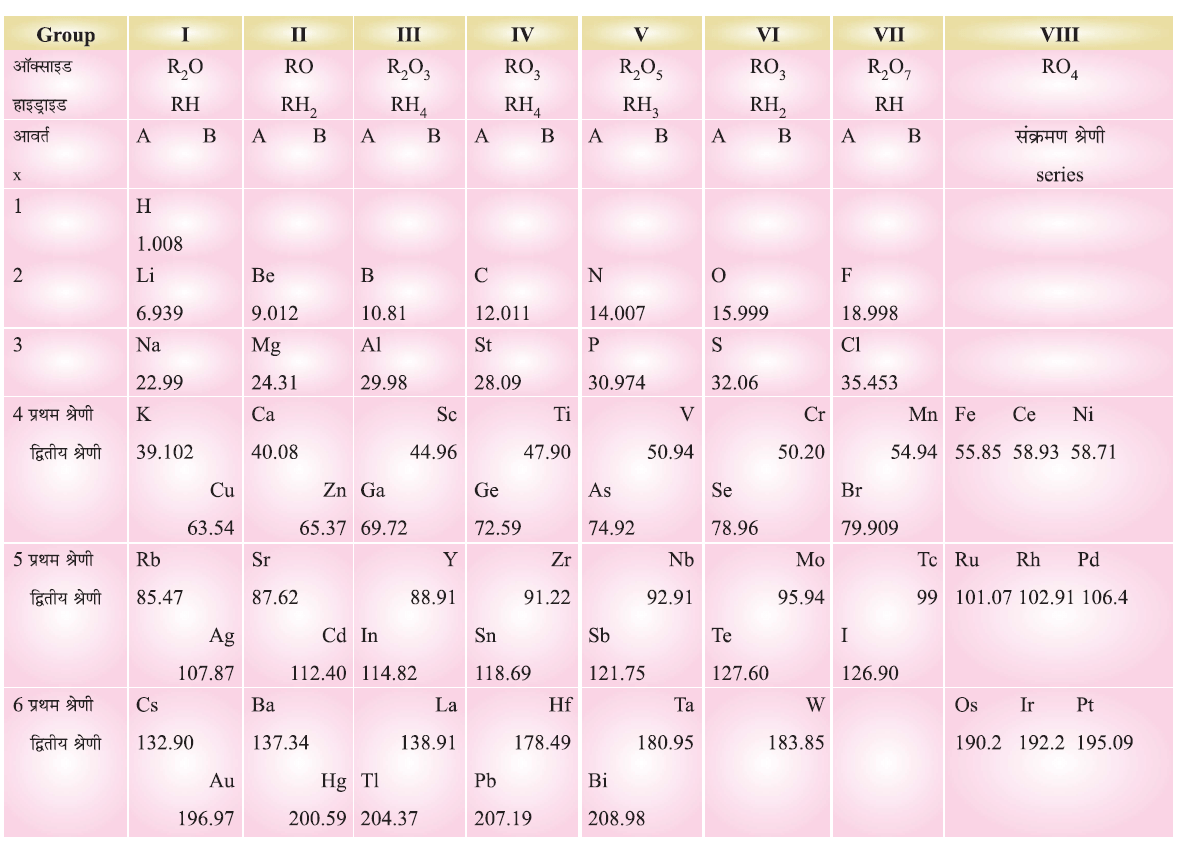
मेंडलीफ की आवर्त सारणी की उपलब्धियाँ (Merits):
- अज्ञात तत्वों के लिए रिक्त स्थान छोड़े गये; जैसे स्कैडियम (Sc), गैलियम (Ga) तथा जर्मेनियम (Ge)
- समान गुणधर्म वाले तत्वों को एक साथ स्थान मिल गया।
- पिछली व्यवस्था को छोड़े बिना ही, अक्रिय गैसों का पता लगने पर इन्हें अलग समूह में रखा जा सकता था।
मेंडलीफ की आवर्त सारणी की सीमाएँ (Limitations):
- समस्थानिकों (isotopes) की स्थिति स्पष्ट नहीं की।
- हाइड्रोजन का स्थान निश्चित ना होना।
- कुछ तत्वों का परमाणु द्रव्यमानों के अनुसार अनुचित क्रम।
आधुनिक आवर्त सारणी (Modern Periodic Table):
तत्व के परमाणु द्रव्यमान की तुलना में उसका परमाणु संख्या अधिक आधारभूत गुणधर्म है। परमाणु संख्या के आधार पर तत्वों को सजा कर आवर्त सारणी को संशोधित रूप में प्रस्तुत क गया जिसे आधुनिक आवर्त सारणी कहते हैं।
आधुनिक आवर्त नियम के अनुसार– “तत्व के गुणधर्म उसकी परमाणु संख्या का आवर्त फलन (periodic function) होते हैं।”
आधुनिक आवर्त सारणी में 18 उर्ध्व स्तंभ (vertical columns) हैं जिन्हें ‘समूह’(groups) कहा जाता है तथा 7 क्षैतिज पंक्तियाँ (horizontal row) है जिन्हें आवर्त (periods) कहा जाता है।
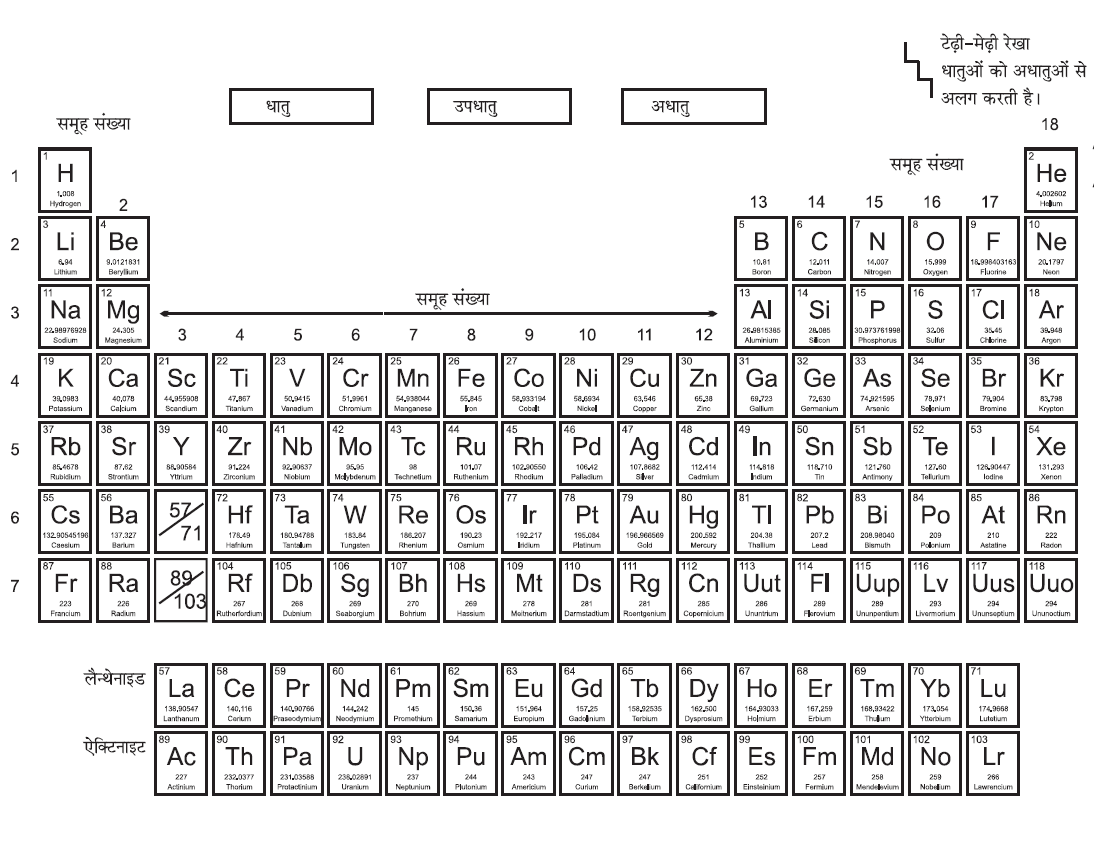
✍ आधुनिक आवर्त सारणी में मेंडलीफ़ की आवर्त सारणी की तीनों कमियों को सुधारा गया जो इस प्रकार है।
- समस्थानिकों की स्थिति स्पष्ट की गई। (समान परमाणु संख्या वाले तत्व एक स्थान पर समान समूह में रखा गया)
- कोबाल्ट जिसकी परमाणु संख्या 27 है वह निकल (परमाणु संख्या 28) से पहले आएगा।
- परमाणु संख्या सदैव पूर्ण संख्या होती है, अतः हाइड्रोजन व हीलियम के बीच में कोई तत्व नहीं आएगा।
परमाणु संख्या (Atomic Number):
परमाणु संख्या को ‘Z’ से निरूपित किया जाता है। परमाणु संख्या अणु के केंद्र में पाए जाने वाले प्रोटॉन की संख्या के बराबर होते हैं।
किसी भी आवर्त में पाए जाने वाले सभी तत्वों में कोशों की संख्या (number of shells) समान होती है।
उदाहरण:
Li (2,1), Be (2, 2), B (2, 3), C (2 ,4), N (2, 5) इन सभी तत्वों में कोशों की संख्या समान है।
- एक समूह के सभी तत्वों में संयोजी इलेक्ट्रॉनों की संख्या समान होती है।
उदाहरण:
समूह 1 ⟶ H – 1
Li – 2, 1
N – 2, 8, 1
K – 2, 8, 8, 1
- सभी तत्वों में संयोजी इलेक्ट्रॉनों की संख्या (1) समान है।
- समूह में नीचे जाने पर कोशों की संख्या बढ़ती जाती है।
- किसी विशेष आवर्त में पाए जाने वाले तत्वों की संख्या इस बात पर निर्भर करती है कि किस प्रकार इलेक्ट्रॉन विभिन्न कोशों में भरे जाते हैं।
- विभिन्न कोशों में भरे जाने वाले इलेक्ट्रॉनों की संख्या के आधार पर आवर्त में तत्वों की संख्या बता सकते हैं।
- किसी कोश में इलेक्ट्रॉनों की अधिकतम संख्या सूत्र 2n2 द्वारा निरूपित की जाती है जहां n दिए गए कोश की संख्या को दर्शाता है।
उदाहरण:
K shell (n = 1) ⟶ 2 x (1)2 = 2 प्रथम आवर्त में 2 तत्व हैं।
L shell (n = 2) ⟶ 2 x (2)2 = 8 दूसरे आवर्त में 8 तत्व हैं।
इसी प्रकार तीसरे, चौथे, पाँचवे, छठे, एवं सातवें आवर्त में तत्वों की संख्या क्रमशः 8, 18, 18, 32, 32 होती है।
आवर्त सारणी में तत्वों की स्थिति उनकी रासायनिक क्रियाशीलता को बताती है।
संयोजकता इलेक्ट्रॉनों द्वारा, तत्वों द्वारा निर्मित आबंध का प्रारूप तथा संख्या निर्धारित होती है।
आधुनिक आवर्त सारणी की प्रवृत्ति (Trends in the Modern Periodic Table):
संयोजकता (Valency):
✍ परमाणु के सबसे बाहरी कोश में उपस्थित इलेक्ट्रॉनों की संख्या संयोजकता कहलाती है।
✍ समूह के ऊपर से नीचे जाने पर संयोजकता समान रहती है परंतु आवर्त में बाएं से दाएं जाने पर पहले 1 से 4 तक बढ़ती है उसके बाद घटकर 0 हो जाती है।
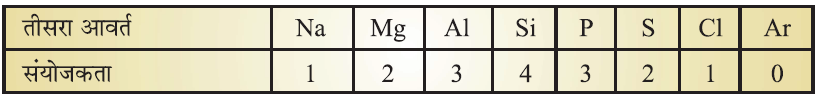
तत्वों का आवर्त वर्गीकरण:
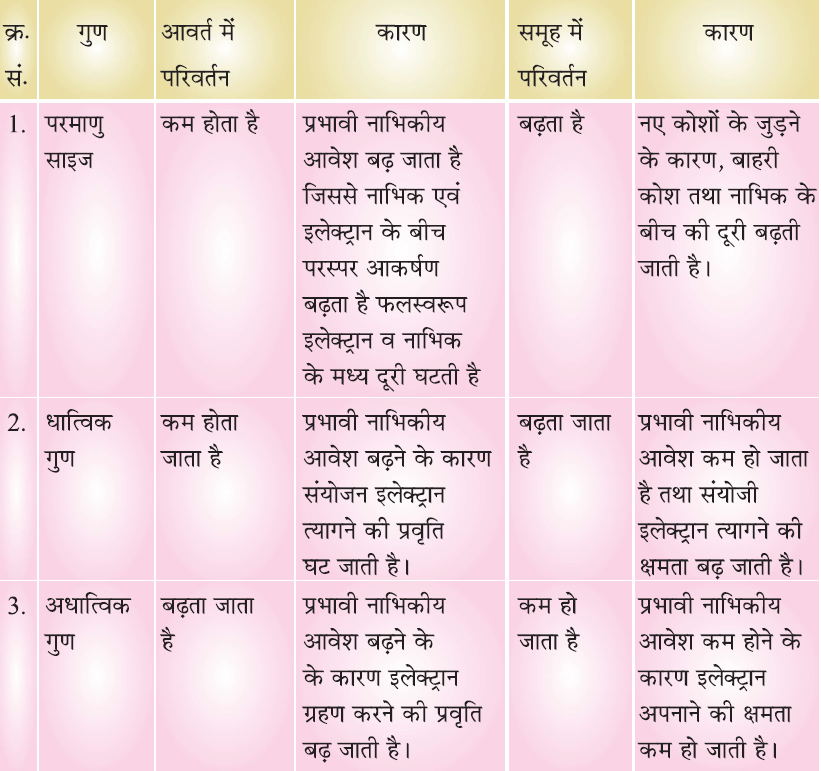
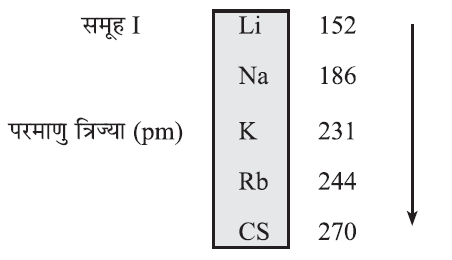
परमाणु साइज (Atomic Size):
✍ परमाणु साइज से परमाणु की त्रिज्या का पता चलता है। एक परमाणु के केंद्र से बाह्यत्तम कोश की दूरी ही परमाणु साइज है।
✍ आवर्त में बाएँ से दाएँ जाने पर परमाणु साइज या त्रिज्या घटती है क्योंकि नाभिकीय अवशेष में क्रमिक वृद्धि होती है।

✍ समूह में ऊपर से नीचे आने पर परमाणु त्रिज्या बढ़ती है क्योंकि नए कोशों की संख्या बढ़ती है जिससे कि नाभिक और बाह्यतम कोश की दूरी बढ़ती जाती है।
धात्विक गुणधर्म (Metallic Character):
- धात्विक गुण का अर्थ है किसी तत्व के परमाणु द्वारा इलेक्ट्रॉन त्यागने की क्षमता।
- धातुएं आवर्त सारणी में बाएं तरफ है।
- आवर्त में बाएं से दाएं जाने पर धात्विक गुण कम हो जाता है क्योंकि इलेक्ट्रॉनों पर नाभिकीय आवेश बढ़ता है, इलेक्ट्रॉन त्यागने की प्रवृत्ति घट जाती है।
- धातु इलेक्ट्रॉन खोते हैं और धनात्मक आयन बनाते हैं। अतः धातु वैद्युत धनात्मक तत्व कहलाते हैं।
- समूह में ऊपर से नीचे आने पर धात्विक गुण बढ़ता है। क्योंकि संयोजकता इलेक्ट्रॉनों पर नाभिकीय आवेश घटता है तथा बाहरी इलेक्ट्रॉन सुगमता पूर्वक निकल जाते हैं।
- धातु ऑक्साइड क्षारीय प्रकृति (basic nature) के होते हैं।
अधात्विक गुणधर्म (Non-metallic Character):
- अधातुएँ वैद्युत ऋणात्मक (electronegative) होती है वे इलेक्ट्रॉनों को ग्रहण करती है।
- अधातुएँ आवर्त सारणी में दाएँ और पाई जाती है।
- आवर्त में बाएँ से दाएँ जाने पर अधात्विक गुण बढ़ता है क्योंकि प्रभावी नाभिकीय आवेश बढ़ने के कारण इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति बढ़ जाती है।
- समूह में ऊपर से नीचे आने पर अधात्विक गुण कम होता जाता है क्योंकि प्रभावी नाभिकीय आवेश कम हो जाता है जिससे इलेक्ट्रॉन अपनाने की क्षमता कम हो जाती है।
- आवर्त सारणी के मध्य में उपधातु या अर्द्ध धातुएँ पाई जाती है। ये कुछ गुण धातुओं के तथा कुछ गुण अधातुओं को दर्शाते हैं।
- अधातु ऑक्साइड अम्लीय प्रकृति (acidic nature) के होते हैं।