
Class 10 Science Chapter 4 कार्बन एवं उसके यौगिक : इस अध्याय में हमलोग कक्षा 10 विज्ञान विषय के अंतर्गत कार्बन, कार्बन यौगिकों के रासायनिक बंधन, कार्बनिक यौगिकों के सूत्र, कार्बनिक यौगिकों का वर्गीकरण, कार्बनिक यौगिकों के IUPAC नामकरण, समावयवी एवं उसके प्रकार, साबुन और अपमार्जक में अंतर आदि के बारे में जानेंगे।
Class 10 Science Chapter 4 कार्बन एवं उसके यौगिक
| पाठ्यपुस्तक | NCERT |
| कक्षा | कक्षा-10 |
| विषय | विज्ञान |
| अध्याय | अध्याय 4 |
| प्रकरण | कार्बन एवं उसके यौगिक |
परिचय (Introduction):
- कार्बन एक अधातु है जिसका प्रतीक ‘C’ है।
- कार्बन भूपर्पटी में खनिजों (कार्बोनेट, हाइड्रोजनकार्बोनेट, कोयला एवं पेट्रोलियम) के रूप में 0.02% तथा वायुमंडल में कार्बन डाइऑक्साइड के रूप में 0.03% उपस्थित है।
- मुक्त अवस्था में कार्बन हीरे, ग्रेफ़ाइट तथा कोयला के रूप में पाया जाता है।
- संयोजित अवस्था में यह मुख्य रूप से कार्बोनेट खनिजों में पाया जाता है।
- सभी सजीवों, पौधे और जंतुओं का शरीर कार्बन यौगिकों का बना होता है।
कार्बन में आबंधन (Bonding in Carbon):
✍ कार्बन हमेशा सहसंयोजक बंधन (Covalent Bonds) बनाता है।
कार्बन की परमाणु संख्या = 6
कार्बन की इलेक्ट्रॉनिक विन्यास
C(6) = K L
C(6) = 2 4
✍ हम जानते हैं की कार्बन के सबसे बाहरी कक्षा में 4 इलेक्ट्रान होता है। चूंकि परमाणु अपने स्थायित्व के लिए अक्रिय गैस के विन्यास को प्राप्त करना चाहता है। अतः कार्बन या तो 4 इलेक्ट्रान का त्याग कर 2 इलेक्ट्रान का स्थायी विन्यास प्राप्त कर ले सकता है या 4 इलेक्ट्रान ग्रहण कर 8 इलेक्ट्रान का स्थायी विन्यास प्राप्त कर ले सकता है।
✍ परंतु कार्बन न तो 4 इलेक्ट्रॉन त्याग कर (C4+ धनायन) और न ही 4 इलेक्ट्रॉन ग्रहण कर (C4– ऋणायन) आयनिक बंधन बनाता है। कार्बन के लिए 4 अतिरिक्त इलेक्ट्रॉनों को ग्रहण करना अत्यंत कठिन है साथ ही कार्बन द्वारा 4 इलेक्ट्रॉन त्यागने के लिए भी अत्यधिक ऊर्जा की आवश्यकता होती है।
✍ अतः कार्बन परमाणु की बाहरी कक्षा के 4 इलेक्ट्रान दूसरे परमाणु के इलेक्ट्रॉनों से साझेदारी कर सहसंयोजक बंधन बनाता है जिससे उसकी बाह्यतम कक्षा में 8 इलेक्ट्रॉन हो जाने से उसे स्थायी विन्यास प्राप्त हो सके।
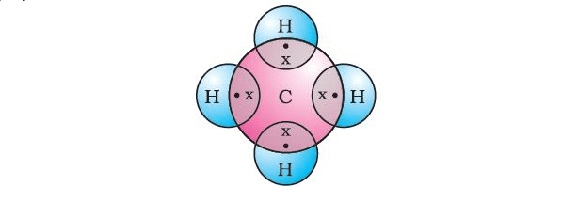
✍ इस प्रकार जब दो परमाणु अपनी बाह्यतम कक्षा के इलेक्ट्रॉनों का आपस में साझेदारी के फलस्वरूप रासायनिक बंधन बनाते है, तब उसे सहसंयोजक बंधन (Covalent Bonds) कहते है। तथा इस प्रकार से निर्मित यौगिक, सहसंयोजक यौगिक कहलाते हैं।
✍ सहसंयोजक बंधन के बनने में दोनों परमाणु इलेक्ट्रानों की साझेदारी इस प्रकार से करते हैं कि निर्मित अणु में प्रत्येक परमाणु एक अक्रिय गैस का स्थायी इलेक्ट्रॉनिक विन्यास प्राप्त कर लेता है।
✍ कार्बन के अतिरिक्त हाइड्रोजन, ऑक्सीजन, नाइट्रोजन और क्लोरीन भी इलेक्ट्रॉनों की साझेदारी से सहसंयोजक बंधन (covalent bond) बनाते हैं।
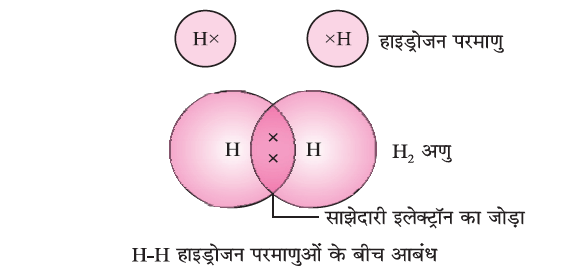
(a) एकल सहसंयोजक बंधन (Single Covalent Bond)
H2
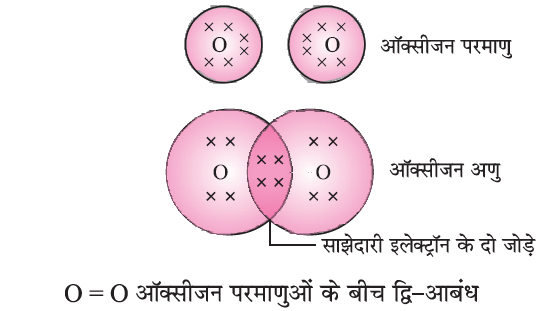
(b) द्विक सहसंयोजक बंधन (Double Covalent Bond)
O2
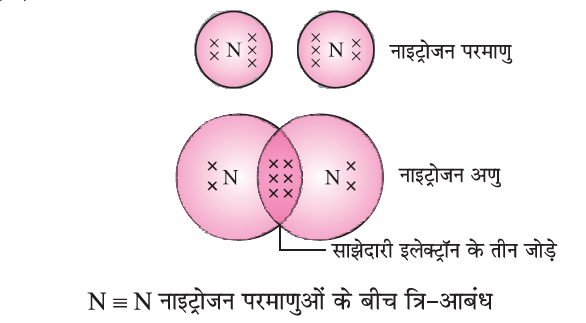
(c) त्रिक सहसंयोजक बंधन (Triple Covalent Bond)
N2
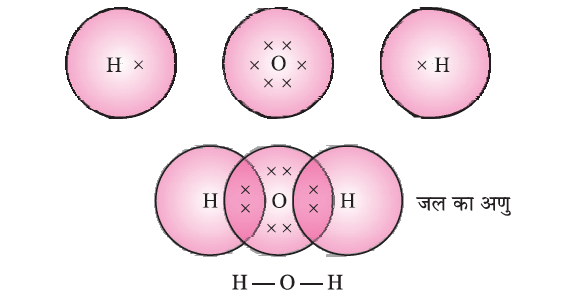
(d) H2 O
जल के अणु में ऑक्सीजन और दो हाइड्रोजन परमाणुओं में एकल आबंध
सह संयोजी यौगीकों (Covalent Compound) के भौतिक गुण-
✍ सह संयोजी यौगिकों के गलनांक (melting) एवं क्वथनांक (boiling) कम होते हैं क्योंकि इनके बीच अंतराअणुक बल (intermolecular force) बहुत कम होता है।
✍ सह संयोजी यौगिक विद्युत के कुचालक (conductor) होते हैं क्योंकि इलेक्ट्रॉनों के बीच और कोई आवेशित कण (charged particles) नहीं होते हैं।
(i) श्रृंखलन (Catenation):
✍ कार्बन में कार्बन के ही परमाणुओं के साथ बंधन बनाने की अद्वितीय क्षमता होती है जिससे बड़ी संख्या में अणु बनते हैं। इस गुण को श्रृंखलन (Catenation) कहते हैं।
✍ इन यौगिकों में कार्बन की लंबी श्रृंखला, कार्बन की विभिन्न शाखाओं वाली श्रृंखला अथवा वलय में व्यवस्थित कार्बन भी पाए जाते हैं। साथ सी कार्बन के परमाणु एक-दूसरे से एकल (single), द्वि (double), या त्रि (triple) आबंध (bond) द्वारा जुड़े हो सकते हैं।
(ii) चतु: संयोजकता (Tetravalency):
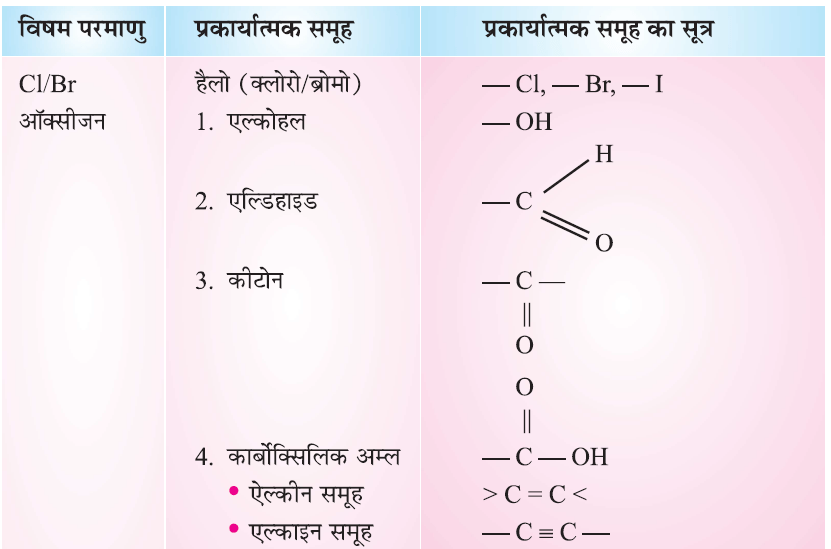
कार्बन परमाणु की संयोजकता 4 है। जिसके कारण कार्बन 4 अन्य कार्बन परमाणु; 1 संयोजी परमाणु (monovalent atoms) (H, Cl) ऑक्सीजन, नाइट्रोजन और सल्फर के साथ आबंध (bond) बना सकता है।
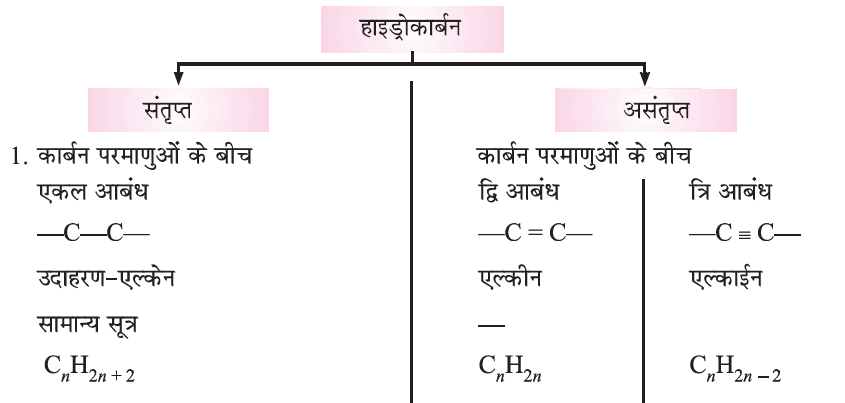
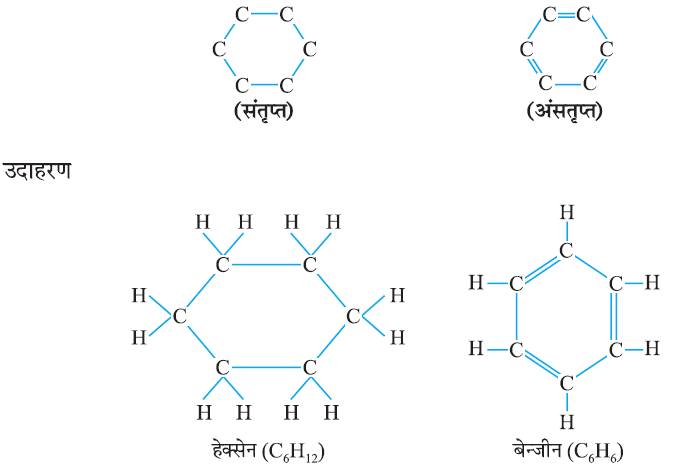
(iii) संतृप्त (Saturated) और असंतृप्त (Unsaturated) कार्बन यौगिक:
कार्बन परमाणु के बीच केवल एक आबंध से जुड़े कार्बन के यौगिक संतृप्त यौगिक कहलाते हैं। द्वि- अथवा त्रि-आबंध वाले कार्बन के यौगिक असंतृप्त यौगिक कहलाते हैं।
Class 10 Science Chapter 4 – कार्बन एवं उसके यौगिक
कार्बनिक यौगिकों के सूत्र
कार्बनिक यौगिकों के सूत्र तीन प्रकार से व्यक्त किये जाते हैं।
(i) लुईस इलेक्ट्रान बिन्दु संरचना (Lewis electron dot structure)
(ii) संरचना सूत्र (Structural formula)
(iii) त्रिविम सूत्र (Three dimensional formula)
इलेक्ट्रॉन बिंदु संरचना (Electron Dot Structure):
हाइड्रोकार्बन:
कार्बन और हाइड्रोजन के यौगिकों को हाइड्रोकार्बन कहते हैं।
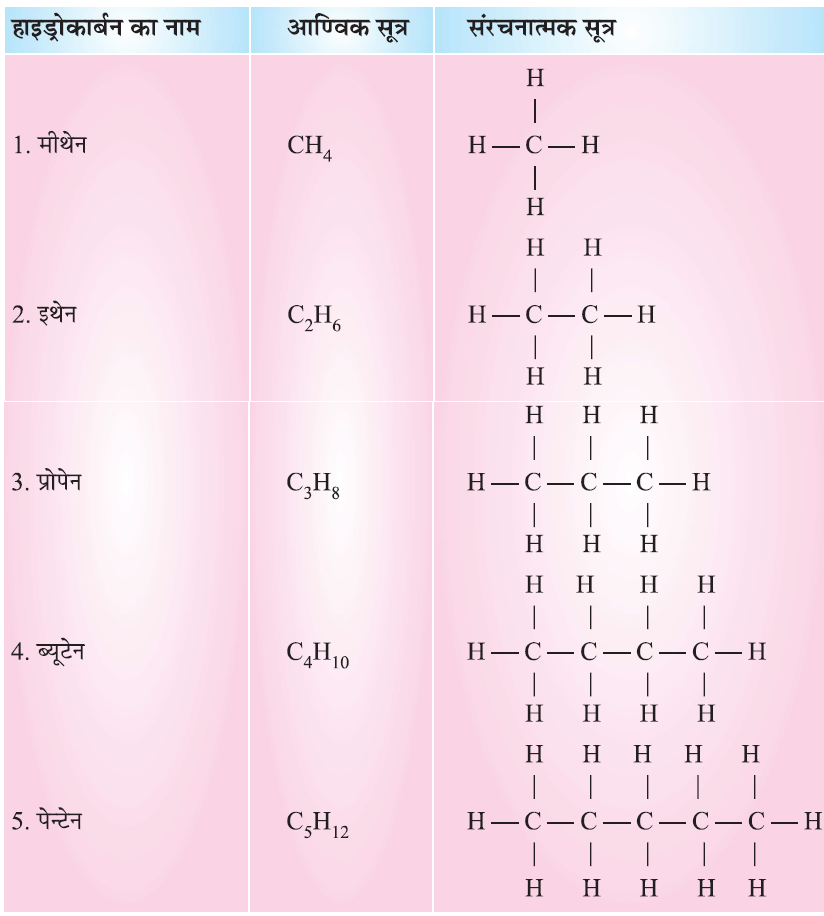
संतृप्त हाइड्रोकार्बन
एथेन C2 H6

संतृप्त हाइड्रोकार्बन के नाम आणविक सूत्र तथा संरचनात्मक सूत्र:
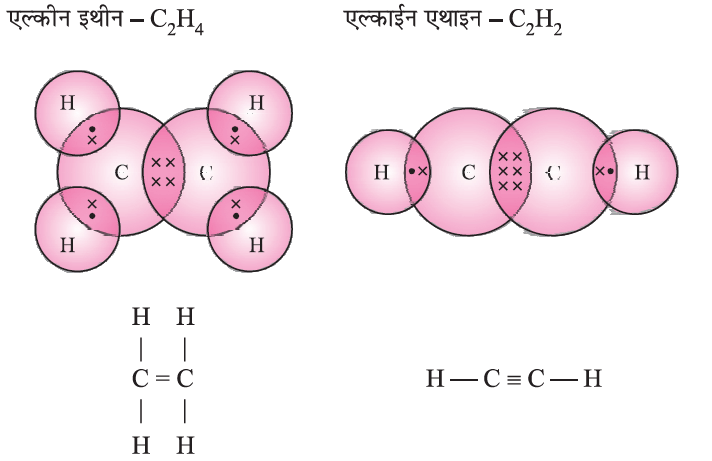
असंतृप्त हाइड्रोकार्बन
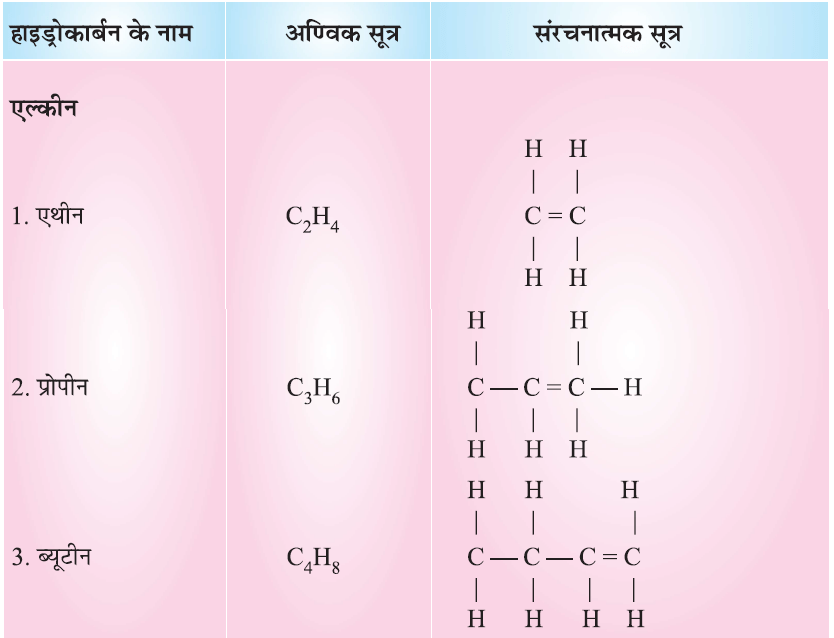
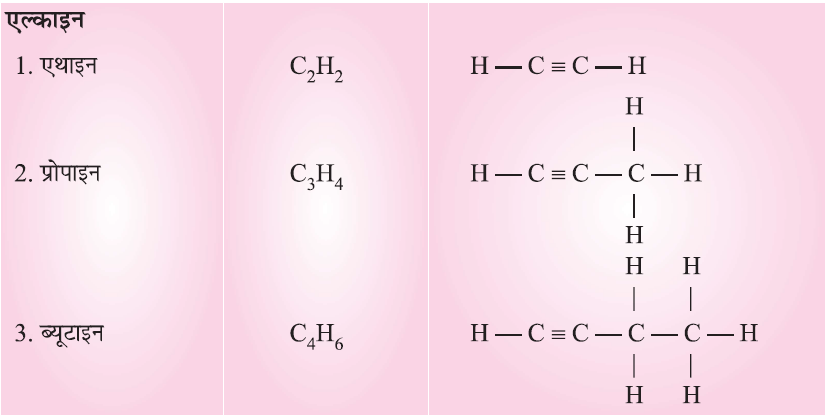
संरचना के आधार पर हाइड्रोकार्बन (Carbon Compound on the Basis of Structure):
(i) सीधी श्रृंखला (Straight Chain):
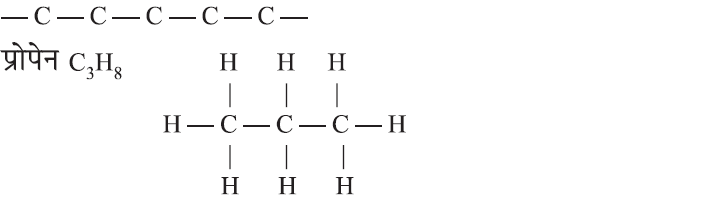
(ii) शाखित श्रृंखला (Branched Chain):
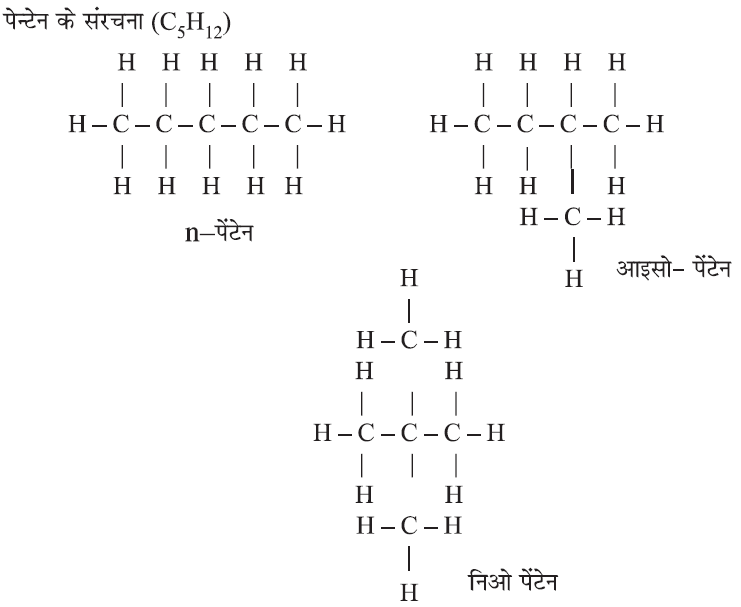
उपरोक्त तीन उदाहरण में आणविक सूत्र सामान है लेकिन भिन्न-भिन्न संरचनाओं वाले ऐसे यौगिकों को संरचनात्मक समावयव कहते हैं।
(iii) वलय श्रृंखला (Cyclic Chain):
प्रकार्यात्मक समूह (Functional Group):
- हाइड्रोकार्बन श्रृंखला में यह तत्व एक या अधिक हाइड्रोजन को इस प्रकार प्रतिस्थापित करते हैं कि कार्बन की संयोजकता संतुष्ट रहती है। ऐसे तत्वों को विषम परमाणु कहते हैं।
- यह विषम परमाणु या विभिन्न परमाणुओं का समूह जो कार्बन यौगिकों को अभिक्रियाशील तथा विशिष्ट गुण प्रदान करते हैं, प्रकार्यात्मक समूह कहलाते हैं।
समजातीय श्रेणी (Homologous Series):
यौगिकों कि वह श्रृंखला जिसमें कार्बन श्रृंखला में स्थित हाइड्रोजन एक ही प्रकार के प्रकार्यात्मक समूह द्वारा प्रतिस्थापित होता है।
उदाहरण- एल्कोहल- CH3OH, C2H5OH, C3H7OH, C4H9OH
- समजातीय श्रेणी के समान सामान्य सूत्र (same general formula) होते हैं।
- समजातीय श्रेणी के उत्तरोत्तर सदस्यों में -CH2 का अंतर तथा 14μ द्रव्यमान इकाई का अंतर होता है।
- समान रासायनिक गुणधर्म तथा अणु द्रव्यमान बढ़ने से भौतिक गुण धर्मों में भिन्नता आती है।
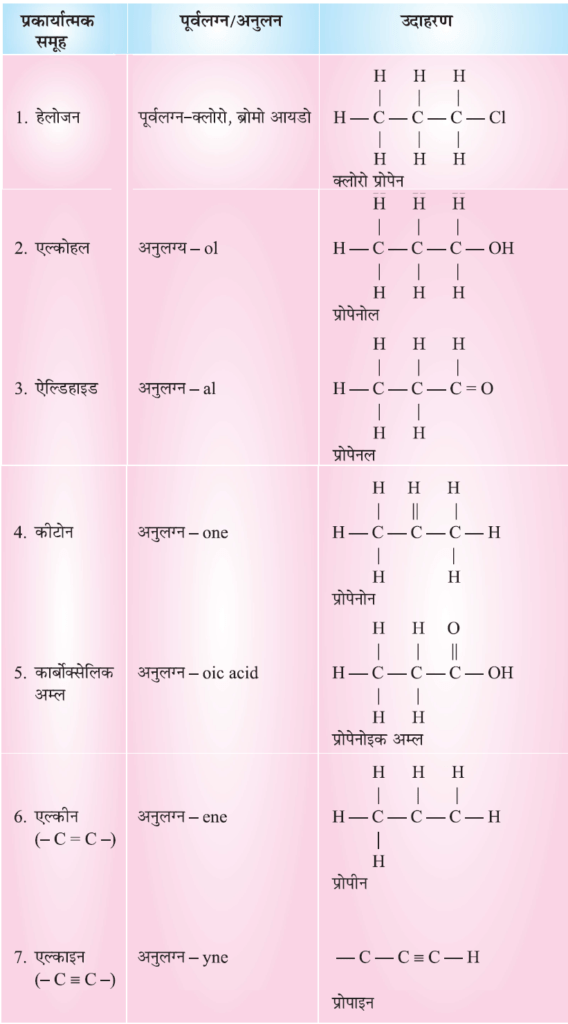
कार्बन यौगिकों की नाम पद्धति (Nomenclature of Carbon Compound):
- यौगिक में कार्बन परमाणुओं की संख्या ज्ञात करो
- प्रकार्यात्मक समूह (functional group) को पूर्वलग्न (prefix) या अनुलग्न (suffix) के साथ दर्शाओं
कार्बन यौगिकों के रासायनिक गुणधर्म (Chemical Properties of Carbon Compounds):
(a) दहन (Combustion):
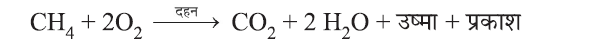
- कार्बन तथा उसके यौगिक इंधन के रूप में इस्तेमाल किए जाते हैं क्योंकि दहन पर प्रचुर मात्रा में ऊष्मा और प्रकाश मुक्त (release) करते हैं।
- संतृप्त हाइड्रोकार्बन वायु की उपस्थिति में जलने पर नीली स्वच्छ ज्वाला उत्पन्न करते हैं।
- असंतृप्त हाइड्रोकार्बन दहन करने पर धुएँ वाली पीली ज्वाला उत्पन्न करते हैं क्योंकि असंतृप्त हाइड्रोकार्बन में कार्बन की प्रतिशत मात्रा संतृप्त हाइड्रोकार्बन से अधिक होती है और वायु की उपस्थिति में कार्बन का पूर्ण उपचयन नहीं हो पाता।
(b) ऑक्सीकरण (Oxidation):
क्षारीय पोटैशियम पेरमेंगनेट (KMnO4) या अम्लीय पोटैशियम डाईक्रोमेट (K2Cr2O7) की उपस्थिति में एल्कोहल कार्बोक्सिलिक अम्ल में परिवर्तित होते हैं।
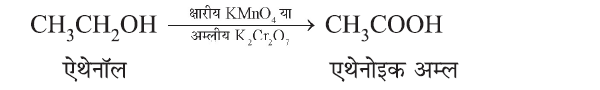
(c) संकलन अभिक्रिया (Addition Reaction):
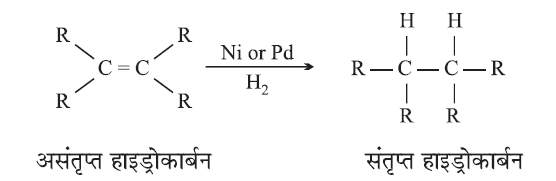
- पैलेडियम या निकेल जैसे उत्प्रेरक की उपस्थिति में असंतृप्त हाइड्रोकार्बन हाइड्रोजन छोड़कर संतृप्त हाइड्रोकार्बन बनाते हैं।
- वनस्पति तेल से वनस्पति घी का निर्माण इस विधि द्वारा किया जाता है।
(d) प्रतिस्थापन अभिक्रिया (Substitution Reaction):
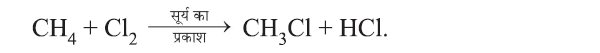
कुछ महत्वपूर्ण कार्बन यौगिक: एथेनॉल (Ethanol) और एथेनॉइक अम्ल (Ethanoic Acid)
एथेनॉल (Ethanol):
भौतिक गुणधर्म (Physical Properties):
- रंगहीन गंध और जलने वाला स्वाद
- जल में घुलनशील
- वाष्पशील द्रव जिसका क्वथनांक 315 K
- उदासीन प्रकृति
रासायनिक गुणधर्म (Chemical Properties):
सोडियम के साथ अभिक्रिया
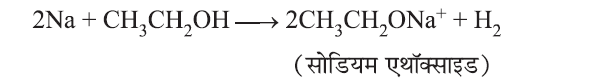
हाइड्रोजन गैस की उत्पत्ति से एथेनॉल की जांच इस अभिक्रिया द्वारा की जा सकती है।
निर्जलीकरण
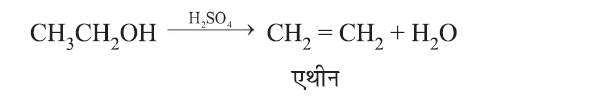
एथेनॉइक अम्ल या एसीटिक अम्ल (Ethanoic Acid):
भौतिक गुणधर्म (Physical Properties):
- रंगहीन द्रव, स्वाद में खट्टा, सिरके जैसी गंध
- क्वथनांक 391 K
- शुद्ध एथेनॉइक अम्ल शीतलन करने पर बर्फ की तरह जम जाता है इसलिए इसे ग्लैशल एसिटिक अम्ल कहते हैं
रासायनिक गुणधर्म (Chemical Properties):
(i) एस्टरीकरण:
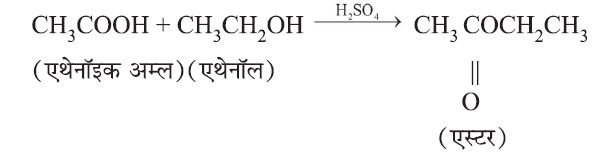
मीठी फलों जैसी गंध वाले एस्टर का निर्माण
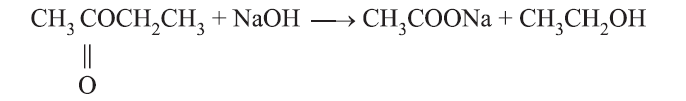
इस विधि से साबुन तैयार किया जाता है।
(ii) क्षार से अभिक्रिया:
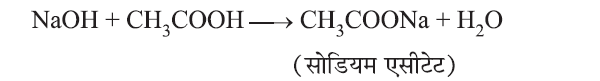
(iii) कार्बोनेट तथा हाइड्रोजन कार्बोनेट से अभिक्रिया:
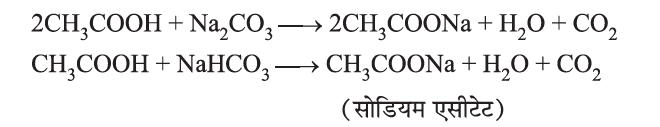
साबुन और अपमार्जक (Soap and Detergent):
- साबुन लंबी श्रृंखला वाले कार्बोक्सिलिक अम्लों के सोडियम पोटैशियम लवण होते हैं। उदाहरण – C17H35COONa+
- साबुन केवल मृदु जल में सफाई किया करते हैं।
- अपमार्जक –लंबी श्रृंखला वाले कार्बोक्सिलिक अम्लों के अमोनियम या सल्फ़ोनेट लवण होते हैं।
- अपमार्जक कठोर एवं मृदु जल में सफाई किया करते हैं।
साबुन अणु में-
- जलरागी सिरा (Hydrophilic Part) (आयनिक भाग)
- जलविरागी सिरा (Hydrophobic Part) (लंबी हाइड्रोकार्बन श्रृंखला)
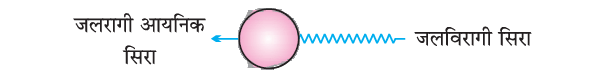
साबुन की सफाई प्रक्रिया (Cleansing Action of Soap):
- मैल तैलीय होते हैं। जलविरागी सिरा तेल में घुल जाता है और जलरागी सिरों के चारों तरफ पानी से घिर जाता है। इससे मिसेली संरचना बन जाती है।
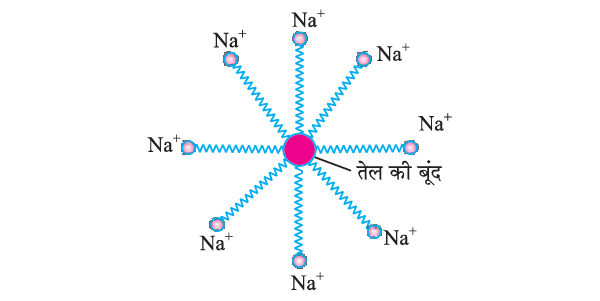
- साबुन का मिसेल मैल को पानी में घुलाने में मदद करता है और कपड़ा साफ हो जाता हैं।
- साबुन कठोर जल में उपस्थित मैग्नीशियम तथा कैल्शियम के लवण के साथ अभिक्रिया करके अघुलनशील पदार्थ स्कम बनाता है। यह स्कम सफाई प्रक्रिया में बाधा डालता है।
- अपमार्जक का उपयोग करके कठोर जल में सफाई प्रक्रिया प्रभावशाली कठोर नल में उपस्थित मैग्निशियम तथा कैल्शियम आयनों के साथ अघुलनशील स्कम नहीं बनाता।
साबुन और अपमार्जक में अंतर:
| साबुन (Soap) | अपमार्जक (Detergent) |
| साबुन लंबी शृंखला वाले उच्च वसा अम्ल (कार्बोक्सिलिक अम्ल) के सोडियम एवं पोटैशियम लवण है। | अपमार्जक लंबी कार्बोक्सिलिक अम्ल शृंखला का अमोनियम सुल्फोनेट लवण है। |
| खारे जल में इनकी कार्य क्षमता घट जाती है अर्थात खारे जल में ये आसानी से झाग नहीं बनाते हैं | खारे जल में भी इनकी कार्य क्षमता कायम रहती है अर्थात खारे जल के साथ भी ये आसानी से झाग बनती है। |
| साबुन को वनस्पति तेल या जन्तु वसा से बनाया जाता है। | संश्लिष्ट अपमार्जक कोयले तथा पेट्रोलियम के हाइड्रो कार्बन से बनते हैं |
| यह जल प्रदूषण नहीं फैलते है। | यह जल प्रदूषण फैलते है। |
