
Class 10 Science Chapter 2 अम्ल, क्षारक एवं लवण – इस अध्याय में हमलोग अम्ल, क्षारक के रासायनिक गुण, अम्ल एवं क्षारक की परस्पर अभिक्रिया, अम्लों व क्षारकों में समानताएँ, pH स्केल, दैनिक जीवन में pH का महत्व, लवणों के गुण तथा कुछ उपयोगी लवणों के बारे में विस्तार से अध्ययन करेंगे।
Class 10 Science Chapter 2 अम्ल, क्षारक एवं लवण
| पाठ्यपुस्तक | NCERT |
| कक्षा | कक्षा-10 |
| विषय | विज्ञान |
| अध्याय | अध्याय 2 |
| प्रकरण | अम्ल, क्षारक एवं लवण |
Class 10 Science Chapter 2 अम्ल, क्षारक एवं लवण
अम्ल (ACID):
◆ ACID शब्द लैटिन भाषा से लिया गया है जिसका अर्थ है खट्टा।
◆ ये स्वाद में खट्टे होते हैं।
◆ ये नीले लिटमस को लाल में बदल देते हैं।
◆ ये जलीय विलयन में H+ आयन देते हैं।
प्रबल अम्ल (Strong Acids): HCl (हाइड्रोक्लोरिक अम्ल), H2SO4 (सल्फ्यूरिक अम्ल), HNO3 (नाइट्रिक अम्ल)
दुर्बल अम्ल (Weak Acids): CH3COOH (एसीटिक अम्ल), C3H6O3 (लैक्टिक अम्ल), C2H2O4 (ऑक्सैलिक अम्ल)
✳ सान्द्र अम्ल (Concentrated Acid): जिसमें अम्ल अधिक मात्रा में होता है, जबकि जल अल्प मात्रा में होता है।
✳ तनु अम्ल (Dilute Acid): जिसमें अम्ल अल्प मात्रा में होता है, जबकि जल अधिक मात्रा में होता है।
क्षारक (BASE):
◆ ये स्वाद में कड़वे होते हैं।
◆ ये लाल लिटमस को नीले में बदल देते हैं।
◆ ये जलीय विलयन में OH– आयन देते हैं।
प्रबल क्षारक (Strong Bases): NaOH (सोडियम हाइड्रोक्साइड), KOH (पोटैशियम हाइड्रोक्साइड), Ca(OH)2 (कैल्शियम हाइड्रोक्साइड)
दुर्बल क्षारक (Weak Bases): NH4OH (अमोनियम हाइड्रोक्साइड)
✳ क्षार (Alkali): जल में घुलनशील क्षारक को क्षार कहते हैं।
✍ सभी क्षार, क्षारक होते हैं परंतु सभी क्षारक, क्षार नही होते।
Class 10 Science Chapter 2 अम्ल, क्षारक एवं लवण
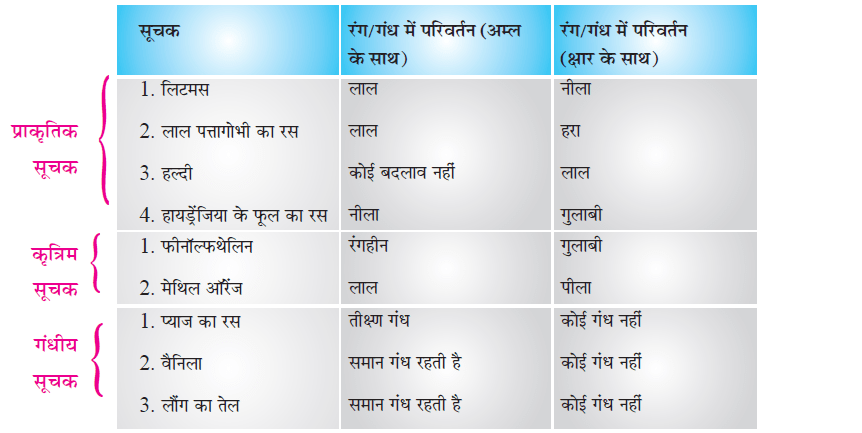
सूचक (Indicators):
सूचक किसी दिए गए विलियन में अम्ल या क्षारक की उपस्थिति दर्शाते हैं। इनका रंग या गंध अम्लीय या क्षारक माध्यम में बदल जाता है।
सूचक के प्रकार (Types of Indicators):
a. प्राकृतिक सूचक (Natural Indicator):
b. कृत्रिम (संश्लेषित) सूचक (Synthetic Indicator):
c. गंधीय सूचक (Olfactory Indicator):
Class 10 Science Chapter 3 धातु एवं अधातु
अम्ल तथा क्षारक के साथ धातुओं की अभिक्रिया:
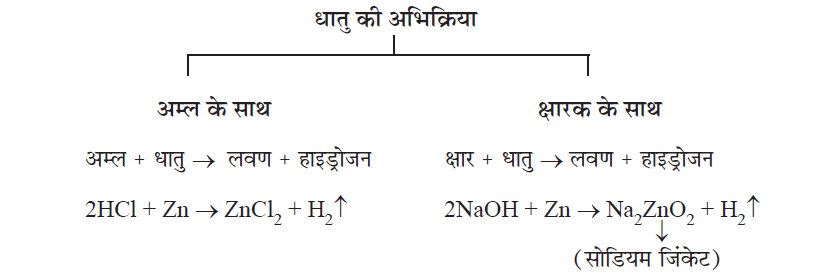
✍ सक्रियता श्रेणी में हाइड्रोजन से ऊपर की धातुएँ अम्ल के साथ अभिक्रिया कर लवण एवं हाइड्रोजन गैस बनती है। सक्रियता श्रेणी में उपस्थित धातु हाइड्रोजन से जितना ऊपर स्थित होता है उतना ही वह सक्रिय माना जाता है।
✍ सक्रियता श्रेणी में हाइड्रोजन से नीचे स्थित धातुएँ अम्ल के साथ अभिक्रिया नहीं करती जब तक कोई ऑक्सीकारक नहीं डाला जाता है। नाईट्रिक अम्ल ऑक्सीकारक है
✳ पॉप टेस्ट : हाइड्रोजन गैस से निहित परखनली के पास जब एक जलती हुई मोमबत्ती लाई जाती है, तो पॉप की ध्वनि उत्पन्न होती है। इस टेस्ट को हाइड्रोजन की उपस्थिति दर्शाने के लिए प्रयोग करते हैं।
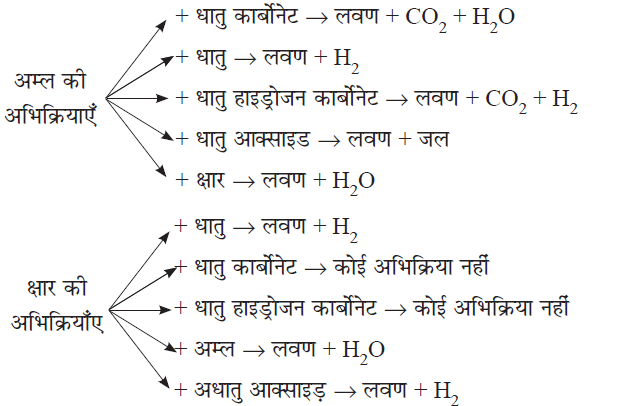
धातु के कार्बोनेट एवं बाइकार्बोनेट से अम्लों की अभिक्रिया:
✍ धातु के कार्बोनेट एवं बाइकार्बोनेट अम्ल से अभिक्रिया कर लवण, जल एवं कार्बन डाइऑक्साइड बनाता है।

✳ CO2 की जांच टेस्ट: उत्पादित कार्बन डाइआक्साइड को चुने के पानी से प्रवाहित करने पर पानी दूधिया हो जाता है।
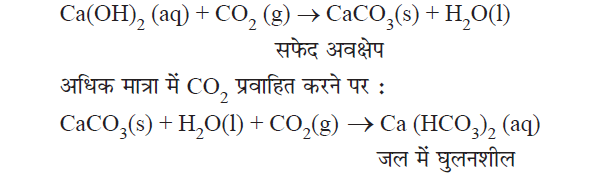
अम्ल एवं क्षारक की परस्पर अभिक्रिया:
NaOH + HCl → NaCl + H2O
क्षारक + अम्ल → लवण + जल
✳ उदासीनिकरण अभिक्रिया: जब अम्ल द्वारा क्षारक का प्रेक्षित प्रभाव तथा क्षारक द्वारा अम्ल का प्रभाव समाप्त हो जाता है और परिणाम स्वरूप लवण और जल प्राप्त होता है तो उदासीनिकरण अभिक्रिया होती है।
उदाहरण:
NaOH (aq) + HCl (aq) → NaCl (aq) H2O (l)
◆ प्रबल अम्ल + दुर्बल क्षारक → अम्लीय लवण + जल
◆ दुर्बल अम्ल + प्रबल क्षारक → क्षारीय लवण + जल
◆ प्रबल अम्ल + प्रबल क्षारक → उदासीन लवण + जल
◆ दुर्बल अम्ल + दुर्बल क्षारक → उदासीन लवण + जल
धातु के ऑक्साइड की अम्ल से अभिक्रिया:
धात्विक ऑक्साइड + अम्ल → लवण + जल
CuO + H2 SO4 → CuSO4 + H2O
CaO + 2HCl → CaCl2 + H2O
✍ धात्विक ऑक्साइड की प्रवृति क्षारीय होती है । क्योंकि ये अम्ल के साथ क्रिया करके लवण और जल बनाते हैं।
उदाहरण: CuO, MgO
अधात्विक ऑक्साइड की क्षारों के साथ अभिक्रिया:
अधात्विक ऑक्साइड + क्षार → लवण + जल
CO2 + Ca(OH)2 → CaCO3 + H2O
✍ अधात्विक ऑक्साइड प्रवृति में अम्लीय होते हैं तथा विद्धुत धारा प्रवाहित करते हैं।
अम्लों व क्षारकों में समानताएँ:

✍ जब कोई अम्ल या क्षारक जल में मिलाया जाता है तो ये तनूकृत हो जाता है। जल में मिलने पर आयन की सांद्रता H3O+ या OH– में प्रति इकाई आयतन की कमी हो जाती है।
क्षार तथा अम्ल की प्रबलता:
✍ किसी क्षार या अम्ल की प्रबलता उसके द्वारा उत्पन्न H+ आयन या OH– आयनों की संख्या पर निर्भर करती है।
✍ किसी अम्ल या क्षारक की प्रबलता हम एक सर्वभौमिक सूचक द्वारा ज्ञात कर सकते हैं।
जलीय विलयन में अम्ल और क्षारक:
✍ जल की उपस्थिति में अम्ल (HCl), H+ आयन उत्पन्न कहते है।
H+ आयन H3O+ (हाइड्रोनियम आयन के रूप में पाए जाते है।)
H+ + H2O → H3O+
HCl + H2O → H3O+ + Cl–
✍ जल की उपस्थिति में क्षारक (OH–) आयन उत्पन्न करते हैं।
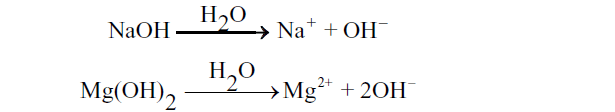
✍ सभी क्षारक जल में घुलनशील नहीं होते हैं। जल में घुलनशील क्षारक को क्षार कहते हैं। सभी क्षार क्षारक होते हैं परंतु सभी क्षारक क्षार नहीं होते।
✍ जल के साथ अम्ल या क्षारक को मिलते समय सावधानी बरतनी चाहिए । हमेशा अम्ल या क्षारक को ही जल में मिलन चाहिए और लगातार इसे हिलाते रहना चाहिए, क्योंकि यह प्रक्रिया अत्यंत ऊष्माक्षेपी है।
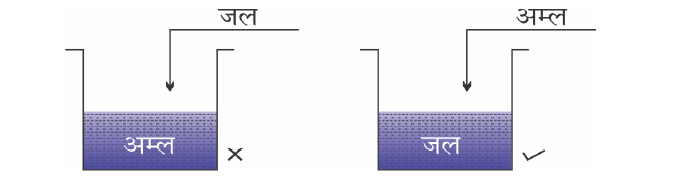
✍ सांद्र अम्ल में जल मिलने पर उत्पन्न हुई ऊष्मा के कारण मिश्रण आस्फलित होकर बाहर आ सकता है तथा आप जल सकते हैं। साथ ही अत्यधिक ताप के कारण काँच का पात्र भी टूट सकता है।
pH स्केल:
✍ किसी विलयन में उपस्थित H+ आयन की सांद्रता ज्ञात करने के लिए सोरेंसन ने (1909) में एक स्केल विकसित किया गया जिसे pH स्केल कहते हैं।
✍ pH में p है पुसांस (Potenz) जो एक जर्मन शब्द है, जिसका अर्थ होता है ‘शक्ति (Power)’।
✍ pH का मान विलयन में हाइड्रोजन आयन की शक्ति को निरूपित करता है
pH= -log [H+]
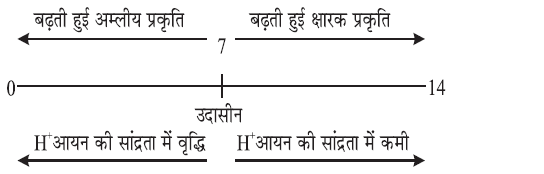
✍ यह स्केल 0 से 14 तक pH ज्ञात करने के लिए उपयोग में लाया जाता है।
यदि,
PH = 7 उदासीन विलयन
PH < 7 अम्लीय विलयन
PH > 7 क्षारीय विलयन
दैनिक जीवन में pH का महत्व:
लवण (SALT):
✍ लवण अम्ल एवं क्षारक की परस्पर अभिक्रया से प्राप्त होता है।
HCL + NaOH ⇾ NaCl + H2 O
अम्ल + क्षारक ⇾ लवण + जल
उदाहरण: NaCI, KCl
लवणों का pH:
◆ प्रबल अम्ल + प्रबल क्षारक → उदासीन लवण pH = 7 → eg NaCl
◆ प्रबल अम्ल + दुर्बल क्षारक → अम्लीय लवण pH < 7 → eg NH4Cl
◆ प्रबल क्षारक + दुर्बल अम्ल → क्षरकीय लवण pH > 7 → eg CH3COONa
कुछ उपयोगी लवण:
सोडियम क्लोराइड (NaCl):
✍ सोडियम हाइड्रोक्साइड तथा हाइड्रोक्लोरिक अम्ल की अभिक्रिया से सोडियम क्लोराइड प्राप्त होता है जिसे हमलोग साधारण नमक के नाम से जानते हैं।
NaOH + HCl → NaCl + H2O
इस प्रकार साधारण नमक हमारे दैनिक उपयोग के कई पदार्थों जैसे- सोडियम हाइड्रोक्साइड, बेकिंग सोडा, वाशिंग सोडा, विरंजक चूर्ण आदि के लिए महत्वपूर्ण कच्चा पदार्थ है।
1. सोडियम हाइड्रोक्साइड (NaOH):
✍ सोडियम क्लोराइड के जलीय विलियन से विद्युत प्रवाहित करने पर यह वियोजित होकर सोडियम हाइड्रोक्साइड उत्पन्न करता है। इस प्रक्रिया को क्लोर-क्षार प्रक्रिया कहते हैं।
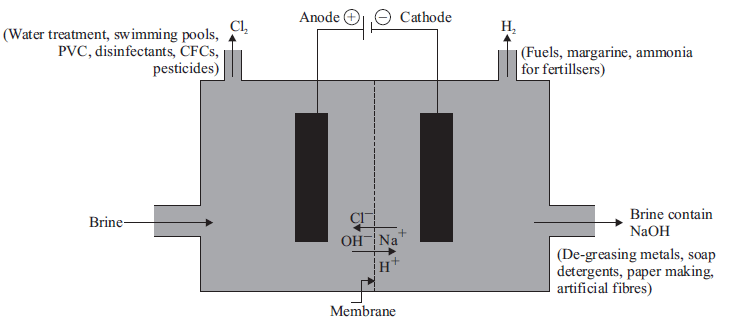
2NaCl (aq) + 2H2O (l) → 2NaOH (aq) + Cl2 (g) + H2 (g)
ऐनोड पर → Cl2 गैस
कैथोडे पर → H2 गैस
कैथोड के पास → NaOH विलयन बनता हैं।
उपयोग :
H2 → ईंधन मार्गरीन
Cl2 → जल की स्वच्छता, PVC, CFC
HCl → इस्पात की सफाई, औषधियाँ
NaOH → धातुओं से ग्रीस हटाने के लिए, साबुन, कागज बनाने के लिए
Cl2 + NaOH → विरंजक चूर्ण → घरेलू विरंजन, वस्त्र विरंजन के लिए
2. विरंजक चूर्ण: (CaOCl2)
शुष्क बुझे हुए चुने [ Ca(OH)2 ] पर क्लोरीन को क्रिया से विरंजक चूर्ण का निर्माण होता है।
Ca(OH)2 + Cl2 → CaOCl2 + H2O
उपयोग:
(a) वस्त्र उद्योग में सूती व लिनेन के विरंजन के लिए।
(b) कागज की फैक्टरी में लकड़ी के मज्जा के विरंजन के लिए।
(c) रासायनिक उद्योगों में एक उपचायक के रूप में।
(d) पीने वाले जल को जीवाणुओं से मुक्त करने के लिए रोगाणु नाशक के रूप में।
3. बेकिंग सोडा: (NaHCO₃)
NaCl + H2O + CO2 + NH3 → NH4Cl+ NaHCO₃
यह एक दुर्बल असंक्षारक क्षारक है।
खाना पकाते समय गर्म करने पर इनमे निम्न अभिक्रिया होती है।
उपयोग :
(a) बेकिंग पाउडर बनाने में (बेकिंग सोडा + टार्टरिक अम्ल)
(b) इस अभिक्रिया से उत्पन्न CO2 के कारण पावरोटी या केक में खमीर उठ जाता है तथा इससे यह मुलायम एवं स्पंजी हो जाता है।
(c) यह ऐन्टैसिड का एक संघटक है।
(d) इसका उपयोग सोडा-अम्ल अग्निशामक में भी किया जाता है।
4. धोने का सोडा: (Na2CO3.10H2O)
सोडियम कार्बोनेट के पुनः क्रिस्टलीकरण से धोने का सोडा प्राप्त होता है। यह एक क्षारकीय लवण है।
Na2CO3 + 10H2O → Na2CO3 10H2O
उपयोग:
(a) इसका उपयोग काँच, साबुन एवं कागज उद्योगों में होता है।
(b) इसका उपयोग बोरेक्स के उत्पादन में होता है।
(c) इसका उपयोग घरों में साफ-सफाई के लिए होता है।
(d) जल की स्थाई कठोड़ता को हटाने के लिए इसका उपयोग होता है।
5. प्लास्टर ऑफ पेरिस: CaSO4.1/2H2O
जिप्सम को 373 K पर गर्म करने पर यह जल के अणुओं को त्याग कर कैल्सियम सल्फेट हेमिहाइड्रेट / अर्धहाइड्रेट (POP) बनाता है।
यह सफेद चूर्ण है जो जल मिलने पर या पुनः जिप्सम बनकर ठोस प्रदान करता है।
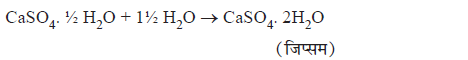
उपयोग:
(a) प्लास्टर ऑफ पेरिस का उपयोग डॉक्टर टूटी हड्डियों को सही जगह पर स्थिर रखने के लिए करते हैं।
(b) इसका उपयोग खिलौना बनाने, सजावट का समान बनाने के लिए किया जाता है।
(c) इसका उपयोग सतह को चिकना बनाने के लिए किया जाता है।
क्रिस्टलीन का जल:
लवण के एक सूत्र इकाई में जल के निश्चित अणुओं की संख्या को क्रिस्टलीन का जल कहते हैं।
उदाहरण:
CuSO4, 5H2O में क्रिस्टलन के जल के 5 अणु हैं।
Na2CO3, 10H2O में क्रिस्टलन के जल के 10 अणु हैं।
CaCO4, 2H2O में क्रिस्टलन के जल के 2 अणु हैं।
