
Class 10 Science Chapter 1 रासायनिक अभिक्रियाएँ एवं समीकरण- इस अध्याय में हमलोग रासायनिक अभिक्रियाएँ किसे कहतें हैं?,रासायनिक अभिक्रियाएँ कितनें प्रकार के होतें है? रासायनिक अभिक्रिया को संतुलित कैसे किया जाता है? आदि प्रश्नों के बारे में विस्तार पूर्वक जानेंगे।
Class 10 Science Chapter 1 रासायनिक अभिक्रियाएँ एवं समीकरण
| पाठ्यपुस्तक | NCERT |
| कक्षा | कक्षा 10 |
| विषय | विज्ञान |
| अध्याय | अध्याय 1 |
| प्रकरण | रासायनिक अभिक्रियाएँ एवं समीकरण |
रासायनिक अभिक्रिया (Chemical Reaction):
✍ जब कोई पदार्थ, अकेले या किसी अन्य पदार्थों से क्रिया करके, भिन्न गुण वाले एक या अधिक नए पदार्थों का निर्माण करता है, तब वह प्रक्रिया रासायनिक अभिक्रिया (Chemical Reaction) कहलाता है।
✍जो पदार्थ किसी रासायनिक अभिक्रिया में भाग लेते है उन्हे अभिकारक (Reactants) कहते हैं और रासायनिक अभिक्रिया के फलस्वरूप जो नए पदार्थ प्राप्त होता है, उन्हें उत्पाद (Products) कहते है।
उदाहरण:
1. भोजन का पाचन
2. श्वसन
3. लोहे पर जंग लगना
4. मैग्नीशियम फीते का जलना
5. दही का बनना
रासायनिक अभिक्रिया के विशेषताएं (Characteristics of Chemical Reaction):
अवस्था में परिवर्तन
रंग मे परिवर्तन
तापमान में परिवर्तन
अवक्षेप का बनना
गैस का उत्सर्जन
रासायनिक अभिक्रिया को प्रदर्शित करना (Ways of Representing Chemical Reaction):
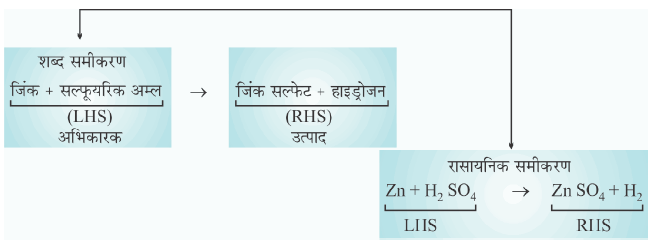
रासायनिक समीकरण (Chemical Equation):
✍ रासायनिक अभिक्रिया (Chemical Reaction) में भाग लेने वाले पदार्थों के संकेतों एवं सूत्रों की सहायता से उस अभिक्रिया का संक्षिप्त निरूपण ही रासायनिक समीकरण (chemical equation) कहलाता है।
उदाहरण: हाइड्रोजन और क्लोरीन के मिश्रण को सूर्य के प्रकाश में रखने पर हइड्रोजन क्लोराइड बनता है जिसे रासायनिक समीकरण के द्वारा निम्न प्रकार से निरूपित किया जाता है।
H2 + Cl2 ⟶ 2 HCl
✍ रासायनिक समीकरण में तत्वों को प्रतीक या अभिकारक और उत्पादों के रासायनिक सूत्र उनकी भौतिक अवस्था के साथ लिखे जाते हैं।
✍ रासायनिक अभिक्रिया में आवश्यक परिस्थितियाँ जैसे- ताप (temperature), दाब (pressure), उत्प्रेरक (catalyst) आदि को तीर के निशान के ऊपर या नीचे दर्शाया जाता है।
Class 10 Science Chapter 1 रासायनिक अभिक्रियाएँ एवं समीकरण
रासायनिक समीकरण को संतुलित करना (Balancing Chemical Equation):
✍ यदि किसी रासायनिक समीकरण के अभिकरकों एवं उत्पादों अर्थात दोनों तरफ के प्रत्येक तत्व के परमाणु की संख्या समान हो तो ऐसे समीकरण को संतुलित रासायनिक समीकरण (Balanced Chemical Equation) कहते है।
✍ यदि समीकरण संतुलित नहीं है तो उसे संतुलित करना आवश्यक है। इसे हम चरणबद्ध (stepwise) तरीके से संतुलित करते हैं।
चरण 1: रासायनिक समीकरण लिखकर, प्रत्येक सूत्र के चारों और बॉक्स बना लीजिए।

चरण 2: समीकरण में उपस्थित विभिन्न तत्वों के परमाणुओं की संख्या नोट कर उसका एक सारणी बनाए।

चरण 3 : सबसे अधिक परमाणु वाले तत्व को अभिकारक या उत्पाद की साइड अनुचित गुणांक लगाकर संतुलित कीजिए।
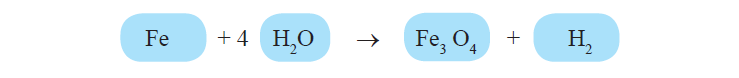
चरण 4: सभी तत्वों के परमाणुओं को चरण 3 की भांति संतुलित कीजिए।

✍ यहाँ सभी तत्वों के परमाणुओं की संख्या अभिक्रिया के दोनों ओर समान है।
चरण 5: अभिकरकों एवं उत्पादों की भौतिक अवस्था लिखना।
ठोस – (s), द्रव – (l), गैसीय अवस्था – (g), जलीय अवस्था – (aq)

चरण 6: कुछ आवश्यक परिस्थितियां जैसे- ताप, दाब, या उत्प्रेरक आदि को भी तीर के निशान के ऊपर या नीचे लिखें।
रासायनिक अभिक्रियाओं के प्रकार (Types of Chemical Reaction):
1. संयोजन या संश्लेषण अभिक्रिया (Combination Reaction):
✍ संयोजन अभिक्रिया में, दो या दो से अधिक पदार्थ (तत्व या यौगिक), परस्पर संयोग करके एक नए पदार्थ का निर्माण करते हैं। नए पदार्थ के गुण मूल पदार्थ के गुण से बिल्कुल भिन्न होते हैं।
A + B ⟶ C
(i) कोयले का दहन:
C (s) + O2 (g) ⟶ CO2 (g)
(ii) जल का निर्माण:
2 H2 (g) + O2 (g) ⟶ 2 H2O (I)
✳ ऊष्माक्षेपी अभिक्रिया (Exothermic Reactions): जिन अभिक्रियाओं में उत्पाद के निर्माण के साथ-साथ ऊष्मा का भी उत्सर्जन होता है, ऊष्माक्षेपी अभिक्रिया कहलाता है।
(i) प्राकृतिक गैस का दहन:
CH4 (g) + O2 (g) ⟶ CO2 (g) + 2H2 O (g) + ऊष्मा
(ii) श्वसन एक ऊष्माक्षेपी अभिक्रिया है।
C6 H12 O6 (aq) + 6O2 (g) ⟶ 6CO2 (aq) + 6H2 O + ऊष्मा
2. वियोजन या अपघटन अभिक्रिया (Decomposition Reaction):
✍ वियोजन अभिक्रिया में किसी एक बड़े यौगिक के अणु टूट कर दो या दो से अधिक सरल यौगिक बनते हैं। नए यौगिक के गुण मूल यौगिक के गुण से बिल्कुल भिन्न होते हैं।
A ⟶ B + C
(i) कैल्सियम कार्बोनेट का अपघटन:
CaCO3 ⟶ CaO + CO2 ↑
(ii) पोटैशियम क्लोरेट का अपघटन:
2 KCIO3 ⟶ 2 KCI + 3 O2 ↑
✳ ऊष्माशोषी अभिक्रिया (Endothermic Reaction): जिन अभिक्रियाओं में अभिकरकों को तोड़ने के लिए ऊष्मा, प्रकाश या विद्धुत ऊर्जा की आवश्यकता होती है, ऊष्माशोषी अभिक्रिया कहलाती है।
✳ ऊष्मीय वियोजन (Thermal Decomposition): जो वियोजन या अपघटन अभिक्रियाएं ऊष्मा के प्रभाव से कराई जाती है ऊष्मीय वियोजन अभिक्रियाएं कहलाती है।

✳ वैद्युत वियोजन (Electrolytic Decomposition): विद्युत धारा प्रवाहित कर होने वाला वियोजन।
2H2 O (l)  2H2 (g) + O2 (g)
2H2 (g) + O2 (g)
✳ प्रकाशीय वियोजन (Photolytic Decomposition): सूर्य के प्रकाश की उपस्थिति में होने वाला वियोजन।
2AgCl (s) ![]() 2Ag (s) + Cl2 (g)
2Ag (s) + Cl2 (g)
2AgBr (s) ![]() 2Ag (s) + Br2 (g)
2Ag (s) + Br2 (g)
✍ इस अभिक्रिया का उपयोग श्याम -श्वेत पोटोग्राफी में होता है।
3. विस्थापन अभिक्रिया (Displacement Reaction):
✍ जब कोई एक अधिक क्रियाशील तत्व दूसरे काम क्रियाशील तत्व को उसके यौगिक से विस्थापित कर देता है, विस्थापन अभिक्रिया कहलाता है।
✳ किसी कम क्रियाशील धातु का अधिक क्रियाशील धातु द्वारा उसके यौगिकों से विस्थापन:
(i) Fe + CuSO4 ⟶ FeSO4 + Cu
✍ जब लोहे की कील को कॉपर सल्फेट (CuSO4) के जलीय विलयन में डाला जाता है तब लोहा, कॉपर सल्फेट (CuSO4) से कॉपर को विस्थापित कर देता है।
(ii) Zn + CuSO4 ⟶ ZnSO4 + Cu
✳ किसी कम क्रियाशील अधातु का अधिक क्रियाशील आधातु द्वारा उसके यौगिकों से विस्थापन
(i) 2NaBr + Cl2 ⟶ 2NaCl + Br2
(ii) 2Kl + Cl2 ⟶ 2KCl + I2
4. द्विविस्थापन अभिक्रिया (Double Displacement Reaction):
✍ इस अभिक्रिया में उत्पादों का निर्माण, दो यौगिकों के बीच आयनों के आदान प्रदान से होता है।
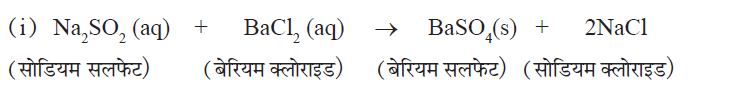
✍ बेरियम सल्फेट (BaSO4) के सफेद अविलेय अवक्षेप का निर्माण होता है। इसलिए इस अभिक्रिया को अवक्षेपण अभिक्रिया भी कहते हैं।
5. उपचयन-अपचयन अभिक्रिया (Oxidation-Reduction Reaction):
✍ उपचयन-अपचयन अभिक्रिया को ऑक्सीकरण-अवकरण अभिक्रिया भी कहते हैं। यह एक विशेष प्रकार की रासायनिक अभिक्रिया है जो हमेशा साथ-साथ होती है। इसे रेडॉक्स अभिक्रिया (Redox Reaction) भी कहते है।
✳ उपचयन (Oxidation): किसी अभिक्रिया के समय जब किसी पदार्थ में ऑक्सीजन की वृद्धि होती है या हाइड्रोजन का ह्रास होता है।
C + O2 ⟶ CO2
2Cu + O2 ⟶ 2CuO
✳ अपचयन (Reduction): किसी अभिक्रिया के समय जब किसी पदार्थ में ऑक्सीजन का ह्रास होती है या हाइड्रोजन की वृद्धि होता है।
2H2 + O2 ⟶ 2HO2
H2 + Cl2 ⟶ 2HCl
CuO + H2 ⟶ Cu + HO2
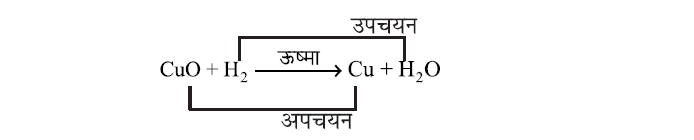
✍ इस अभिक्रिया में कॉपर आक्साइड, कॉपर में अपचयित हो जाता है तथा हाइड्रोजन उपचयित होकर जल बनता है। इस अभिक्रिया में उपचयन तथा अपचयन दोनों एक साथ हो रहा है, इसे उपचयन-अपचयन अथवा रेडॉक्स अभिक्रिया भी कहते हैं।
दैनिक जीवन में उपचयन-अपचयन अभिक्रिया का प्रभाव:
(i) संक्षारण (Corrosion):
✍ जब कोई धातु, ऑक्सीजन, अद्रर्ता, अम्ल आदि के संपर्क में आती है, जिससे धातु की ऊपरी पर्त कमजोर व संक्षारित हो जाता है। लोहे की वस्तुओं पर जंग लगना, चांदी के ऊपर काली पर्त व तांबे के ऊपर हरी पर्त चढ़ना संक्षारण के उदाहरण हैं।
संक्षारण रोकने के उपय:
✍ यशदलेपन (galvanization), विद्युत लेपन (electroplating) और पेन्ट करके संक्षारण से धातुओं को बचाया जा सकता है।
(ii) विकृतगंधिता (Rancidity):
✍ वसायुक्त एवं तैलीय खाद्य सामग्री, वायु के संपर्क में आने पर उपचयित हो जाते है जिससे उनके स्वाद और गंध में परिवर्तन हो जाता है इसे विकृतगंधिता (Rancidity) कहते हैं।
✍ वसा व तेल के ऑक्सीकरण के परिणामस्वरूप अम्ल (acid) बनते हैं। ये अम्ल अप्रिय गंध और बुरा स्वाद देते हैं।
विकृतगंधिता रोकने के उपय:
1. वसा युक्त भोजन में, प्रति ऑक्सीकारक (Antioxidants) का उपयोग करके।
2. खाद्य सामग्री को वायुरोधी बर्तन में रखकर।
4. खाद्य पदार्थों को रिफ्रिजरेटर (Refrigerator) में रख कर।
3. चिप्स की थैली में ऑक्सीजन के स्थान पर नाइट्रोजन गैस का प्रयोग करके।
Class 10 Science Chapter 1 रासायनिक अभिक्रियाएँ एवं समीकरण के इस पोस्ट की मैंने आपलोगों के लिए सभी जानकारियाँ NCERT एवं SCERT की पाठ्यपुस्तक से ही जुटाई है, और कोशिश यह भी किया हैं की इसमें कम से कम गलतियाँ हो। यदि फिर भी कोई गलतियाँ हुवी हो तो आपलोग मुझे Comment करके बाता सकते है। और हाँ, यह पोस्ट आपलोगों को कैसा लगा हमें जरूर बतायेगा।
